
ヒ素試験法について
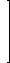 一般財団法人 食品分析開発センターSUNATEC
第一理化学検査室 髙木 優磨
試験法の目的
ヒ素試験法は、食品や食品添加物、医薬品等に含まれるヒ素を試験するために必要である。食品添加物などでは、不純物としての残留や意図的な混入を想定した限度試験として採用されている。
ヒ素は、メタロイド(亜金属、類金属、半金属などとも呼ばれる)に属し、金属と非金属の中間的性質を持ち、自然環境中に広く分布する元素である。主として地殻中に分布しており、火山活動や鉱物の風化などにより地殻から放出され、農地を含めた土壌、水中にも微量ながら存在する。
ヒ素による中毒事例として、添加物中に混入したヒ素によるヒ素ミルク事件や意図的混入によるヒ素入りカレー事件、不法投棄物により生じた地下水汚染による神栖ヒ素汚染などがある。他にも、過去に毒薬として使用されたこともあり、一般的に“ヒ素は毒”という認識がある。ヒ素の毒性は化学形により異なり、有機態のものよりも無機態のもののほうが毒性は強い。無機態ヒ素のうち5価よりも3価のヒ素のほうが毒性は強いが、その中でもアルシン(AsH3)は常温で気体であり、極めて毒性が強く、他のヒ素化合物と異なり、中枢神経系、血液系の障害を引き起こし、急性中毒で頭痛、悪寒、吐き気、呼気のニンニク臭、肺水腫などの症状が現れ、数日後には死に至る。致死量は、0.1 g程度(250 ppm、30分間以内で致死)であり、日本産業衛生学会が勧告する作業環境における許容濃度は0.01 ppm(0.032 mg/m3)とされている。3価のヒ素として一般的なものは、無水亜ヒ酸(三酸化二ヒ素、As2O3)又は亜ヒ酸塩(NaAsO2など)であり、ヒ素入りカレー事件で混入されたものでもある。ヒ素がタンパク質の-SH基と結合し、酵素活性を阻害することで毒性を発現し、細胞毒の様相を呈する。嘔吐、下痢、筋痙攣、腎障害、皮膚潰瘍などを起こし、致死量は0.1~0.3 g程度である。一方5価のヒ素は3価のものと比べて毒性は低く、これは5価のヒ素に-SH基との結合能がないためである。ただし、体内で3価に還元されるなどして毒性を発現することや一部の形態を除いて5価を含む無機態ヒ素は毒物及び劇物取締法上の毒物に指定されていることから取り扱いは十分に注意する必要がある。有機態ヒ素はさらに毒性が低く、生体内での無機態ヒ素の解毒過程の産物と考えられており、高度に代謝されたアルセノベタインでは無毒とされている。魚介類に含まれる有機態ヒ素の毒性等について、本メールマガジンのバックナンバーに紹介があるので、参照されたい(魚介類に含まれるヒ素化合物の毒性および生体内代謝、http://www.mac.or.jp/mail/110901/02.shtml)。
ヒ素自体は環境中、生体中に広く存在するものではあるが、過去の事件等を考えると、環境汚染や意図的な混入による被害を防ぐためにもヒ素をはかることは大切であり、その試験法について紹介する。
試験法
ヒ素をはかるためには、適切な前処理を行い、検液を調製した後、試験紙や機器等を利用して測定しなければならない。ナトリウムなどの一般的な無機成分の分析では、試料を強熱して灰とし、酸に溶解して検液とすることができるが、ヒ素の場合、試料に何も処理せず強熱すると揮散してしまう。また、測定に際しても、ヒ素の価数が3価と5価とで反応性が異なるために還元操作が必要となる場合があるなど、ヒ素の測定に特別な操作が必要となることがある。本稿では、前処理法、測定法の順に紹介する。
1.前処理法
a.乾式灰化法
第8版食品添加物公定書における試験の操作手順を下図に示す。ヒ素試験法の第3法と第4法として採用されている。操作の概略は、試料に硝酸マグネシウムのエタノール溶液を加え、エタノールに点火して燃焼させた後、強熱(450~550℃)して灰化する。残留物に塩酸を加え、加温して溶解し、検液としている。通常、試料をそのまま強熱するとヒ素は揮散する。これは、3価の無水亜ヒ酸(三酸化二ヒ素)の沸点が460℃程度、昇華点が190℃程度であり、より酸化状態となった5価の無水ヒ酸(酸化ヒ素、五酸化二ヒ素)でも、300℃以上に加熱すると分解して無水亜ヒ酸となってしまうことなどによる。しかし、マグネシウム塩を加えることでヒ酸マグネシウム(Mg2As2O7)として捕捉することが可能となる。さらには硝酸マグネシウムが分解して生成する酸化マグネシウムにより、中性~アルカリ性に保つことができるので、揮散を防ぐことができる。この他にも、硝酸塩は灰化補助剤として働き有機物の分解を促進する効果や、酸化マグネシウムはアルカリ金属のように磁性るつぼを侵さないため容器からの汚染のリスクが低いなどの利点がある。後に紹介する湿式分解法に比べ、操作が簡便で多数の試料を処理できるという利点もある。一方で注意しなければならない点として、硝酸マグネシウムのエタノール溶液を試料に十分なじませておく必要があることや硝酸マグネシウムが有機物と激しく反応して試料が飛散することがあること、十分な灰化時間をとらないと硝酸塩や亜硝酸塩が残存し、測定の妨害となりうることなどが挙げられる。
試験法の出典によっては、硝酸マグネシウムの水溶液を加える方法や強熱の温度が異なっていることなどもある。
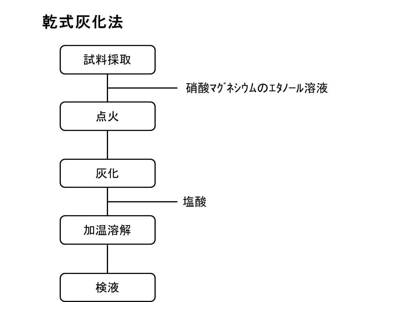
b.湿式灰化法
食品衛生法における清涼飲料水の成分規格(ミネラルウォーター類以外)に定められた試験法の操作手順を下図に示す。操作の概略は、試料に硝酸と硫酸を加えて加熱し、内容液が暗色となるようであれば硝酸を追加する。硫酸の白煙が発生し、内容液が微黄~無色となればシュウ酸アンモニウム溶液を加え、さらに加熱して硫酸白煙を生じさせる。冷後、水を加えて検液としている。硝酸の酸化力と硫酸の脱水作用により試料を分解する方法である。酸化剤を積極的に加えるため、分解速度が速い。試料採取量や加熱条件にもよるが、早ければ数十分間程度で分解することが可能である。乾式灰化法ほど分解温度が高くならないことや常に酸化剤が触れていることで5価のヒ素が3価のヒ素に還元されることを防ぎ、ヒ素が揮散するリスクを抑えている。分解中に内容液が暗色となるのは、硝酸が消費されて硫酸濃度が高まり、残存有機物が硫酸の脱水作用で炭化されるためであり、これを分解が完了したかどうかの目安とできる。ニトロシル硫酸や二酸化窒素などが残存すると後で還元反応を行う場合に妨害するので、これらが残存するリスクを避けるために分解後還元剤であるシュウ酸塩を加えている。注意しなければならない点として、試料によっては、硝酸と硫酸を加えると爆発的に反応し、吹きこぼれてしまうことがあるので、例えば、硝酸だけを加えて一晩放置することや水と硫酸を加え、弱く加熱しながら少量ずつ硝酸を加えていくなど穏やかな条件で予備分解するとよい。分解中に突沸する場合には、ガラス玉を加える、カプリルアルコールを加えるなどにより発泡を穏やかにすることができる。内容液が暗色を呈し、そのまま加熱すると、生じた炭化物が持つ還元力でヒ素が還元して揮散してしまうおそれがあるので、分解が完了するまでは硝酸を欠かさないよう注意しなければならない。揮散のリスクをさらに抑えたい場合には、ロートや時計皿などで覆いながら分解すると、容器内で硝酸が還流してヒ素が揮散しにくくなるとともに、揮散する硝酸量を抑えることができるので、酸の使用量も減らすことができる。また、過熱により硫酸が全て揮散して乾固してしまうことも防げる。ただし、このような蓋をした状態で分解する場合、硝酸がほとんどなくなってしまうと蓋で濃縮した水分が熱濃硫酸に落下して危険なので(通常、硫酸を水で希釈する時は水に硫酸を加え、硫酸に水を加えないのと同じ)、硫酸白煙が生じ始めたら、蓋をずらすなどして、残った水分を逃がしたほうが安全である。
同様な試験法として、より分解を促進するために過塩素酸を加える方法やヒ素の揮散防止を目的としてニッケルイオンを添加する方法などがある。また、ヒ素が3価に還元しないよう過マンガン酸カリウムを加える方法などもある。過塩素酸を加えるとその強力な酸化力によって分解がより早く、より強力に進行するが、過塩素酸と有機物が残存した状態で乾固すると爆発するのでその使用には注意が必要である。硫酸を加えていても、容器の縁で乾固し、火花が散るなどといったことも起こるので、過塩素酸使用時には分解容器から目を離さず、即座に硝酸等を添加できるように準備しておくことが望ましい。これらの他にマイクロウェーブ分解法がある。これは、試料に硝酸(必要に応じて過酸化水素や硫酸、過塩素酸、塩酸なども添加する)を加えて密閉し、マイクロウェーブで加熱することで高温、高圧下で分解する。試料採取量に制約はあるが、密閉状態で分解するため汚染のリスクがほとんどなく、微量分析の前処理法として使用できる。分解後の液は硝酸溶液であるため、水素化物を発生させてヒ化水素として測定する場合には、硫酸を加えて加熱し、硝酸を追い出すなどして液性を変える必要がある。
2.測定法
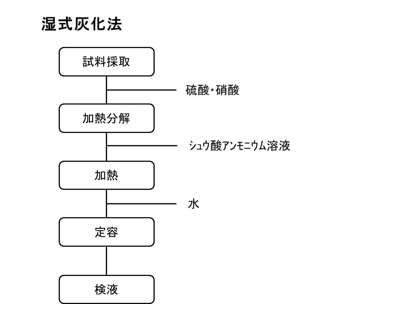
a.グットツァイト法
第8版食品添加物公定書における試験の操作手順を下図に示す。ヒ素試験法の装置A法として採用されている。操作の概略は、検液をアンモニア水と塩酸で中和したのち、塩酸とヨウ化カリウム、塩化スズ(Ⅱ)を加える。さらに亜鉛を加えて発生させたヒ化水素を酢酸鉛が含浸したガラス繊維中に通過させた後、臭化水銀(Ⅱ)紙に捕集し、臭化水銀(Ⅱ)紙の呈色の程度を観察する方法である。塩酸とヨウ化カリウム、塩化スズ(Ⅱ)は、ヒ素を5価から3価へと還元するために加えている。また、ヨウ化カリウムには、鉄や銅などの金属類による負の妨害、ヒ素と同様に水素化物を生成するアンチモンによる正の妨害を防ぐ効果もある。塩酸酸性下に亜鉛を加えることで発生する水素により、亜ヒ酸をヒ化水素として揮発させ、発生するガスを酢酸鉛に触れさせることで混在しうる硫化水素や二酸化硫黄を除去した後、臭化水銀(Ⅱ)と反応して生成する臭化ヒ素水銀錯体の黄色の程度を目視で観察する。
本方法は、有害試薬である臭化水銀(Ⅱ)を使用するため、食品添加物公定書の各条では採用されていない。また、食品衛生法の乳等の容器包装の規格基準に採用されていたが、平成26年末に後に紹介するジエチルジチオカルバミン酸銀法に変更された。今後、公定法から削除されていくと思われる試験法ではあるが、機器を必要とせず、試験紙として検査できる点で、フィールドワーク中など、実験室外で実施可能な試験法として有用と考えられる。また、試験紙の保管方法の問題を解決し、定量性のある検知管を用いた方法もある。
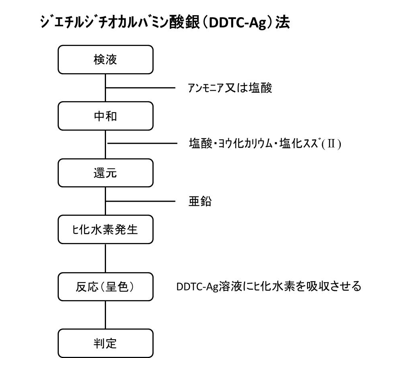
b.ジエチルジチオカルバミン酸銀法
第8版食品添加物公定書における試験の操作手順を下図に示す。ヒ素試験法の装置B法として採用されている。DDTC-Ag法と略されることがある。操作の概略は、グットツァイト法と概ね同じで、最後のヒ化水素を吸収させるものが臭化水銀(Ⅱ)紙ではなく、ジエチルジチオカルバミン酸銀のピリジン溶液であるという違いだけである。本方法では、発生したヒ化水素がジエチルジチオカルバミン酸銀と反応して呈する赤色の程度を観察する(生成物の組成は明らかではなく、可溶性の錯体又はコロイド性の銀によるものといわれている)。食品添加物公定書では同様に反応させた標準液と目視で比較することとなっているが、波長525 nm付近の光の吸光度を測定することで定量でき、検量線はAs2O3として1~10 μg/5mLの範囲で直線性を示す。
他の規格では、ジエチルジチオカルバミン酸銀の溶媒として悪臭を伴うピリジンではなく、ブルシンのクロロホルム溶液を使用しているものもある。ただし、ブルシンは毒性が非常に強いため取り扱いには注意が必要である。食品衛生法における清涼飲料水の成分規格(ミネラルウォーター類以外)では中和操作を実施しないが、これは、操作ブランクにヒ素を添加したものを比較標準としており、試料と比較標準間で酸濃度がほぼ同じであるため省略されたと思われる。
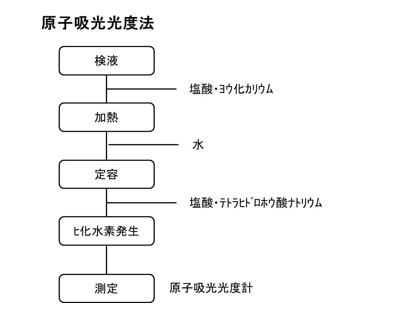
c.原子吸光光度法
第8版食品添加物公定書における試験の操作手順を下図に示す。ヒ素試験法の装置C法として採用されている。操作の概略は、グットツァイト法と概ね同じで、塩化スズ(Ⅱ)と亜鉛の代わりにテトラヒドロホウ酸ナトリウムで還元と水素化を行い、発生したヒ化水素を原子吸光光度計で測定する。試薬の添加量、濃度は、使用する装置に合わせて適宜変更してもよい。原子吸光光度計は、加熱吸収セルを取り付けたものを使用し、波長193.7 nmの光の吸光度を測定する。ヒ化水素としてではなく検液を直接導入して測定した場合、感度が不足する。これは、ネブライザで霧化した溶液を燃焼させて測定するよりも気体であるヒ化水素として導入したほうがヒ素の導入量が多く、共存物質がほとんど存在しないため干渉も受けにくいことによる。また、加熱吸収セルを電気加熱ではなくフレームで加熱する場合、遠紫外域で透過性のよい水素・窒素フレームまたは水素・アルゴンフレームなどを用いる。出典によっては、還元剤としてヨウ化カリウムとともにアスコルビン酸を加えているものもある。 その他の方法として、電気加熱原子吸光光度法(フレームレス原子吸光光度法、グラファイトファーネス原子吸光光度法)がある。円筒状の黒鉛の炉に検液を入れ黒鉛炉を通電して加熱すると、検液が乾燥、灰化、原子化し、生じた原子蒸気層における光の吸光度を測定する方法である。炉の中という狭い空間に原子蒸気が生成するため、高感度分析が可能となりわずか数μLの検液で測定できる。還元操作や水素化物発生の必要がないので、検液中に硝酸塩が残留しても測定可能であり、さらには検液を硝酸溶液とすることもできる。ただし、検液中の共存物質や炉の昇温条件等により測定値がばらつきやすく、精度良く測定するためには熟練を要する。
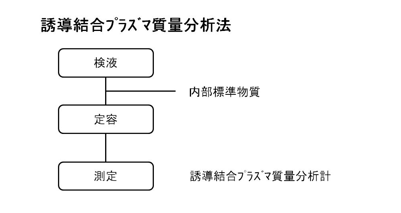
d.誘導結合プラズマ質量分析法
試験の操作手順を下図に示す。誘導結合プラズマ質量分析法(ICP-MS法)とは、ネブライザを用いて霧化した検液を高温のアルゴンプラズマ中に導入することで、原子がイオン化され、生じたイオンを質量分析計に導入し、質量電荷比ごとに分離、定量する方法である。ミネラルウォーター類中の元素類一斉試験法などで本方法は採用されている。質量分析計を用いるので高感度であり、電気加熱原子吸光光度法と同様、検液を直接測定できる。水素化物を発生させて導入することでさらに高感度で測定することができる。また、検液を硝酸溶液とすることができ、環境汚染の少ないマイクロウェーブ分解法と合わせることで微量分析、超微量分析も可能である。原子吸光光度法などと比較して、感度変動が起こりやすいことや炭素による増感効果などがみられるため、一般に内部標準法が用いられる。内部標準元素は、試料に含まれていないこと、スペクトル干渉を起こさないこと、同程度のイオン化率や質量数を有することなどを踏まえて選定されるが、採用される元素の例として、イットリウム(Y)、ロジウム(Rh)、インジウム(In)、テルル(Te)などがある。また、検液中に残留する炭素による増感効果を防ぐために、標準液と検液に酢酸を加えて増感効果を飽和させる方法もある。測定可能な質量数は75のみであり、プラズマを構成するアルゴンと検液中に混入しうる塩素からなる多原子イオン(40Ar 35Cl)と質量数が同じという問題がある。この解決策として、干渉補正式を用いる場合は、40Ar 37Clの強度を測定しておき、35Clと37Clの同位体比から40Ar 35Clの強度を算出する。より操作が簡便な方法としてコリジョン・リアクションセルによって多原子イオンによる干渉を抑制する方法がある。これは、質量分離部導入前のセルにガスを導入し、ガスが多原子イオンに衝突した際に、多原子イオンを解離させる、多原子イオンの運動エネルギーや電荷を奪うなどして多原子イオンの質量分離部への導入を防ぐ方法である。あえてヒ素を酸化させ、75As16Oを測定する方法もある。
高価な機器ではあるが、使用にあたり電気加熱原子吸光光度法のような熟練を必要とせず、微量分析が可能であり、他の元素との一斉分析も可能であるため、利点は大きい。
e.その他
ヒ素の価数ごとの含量や有機態ヒ素の種類ごとの含量を測定する方法として、高速液体クロマトグラフィーでこれらの成分を分離した後、誘導結合プラズマ質量分析計などに直接導入する方法がある。蛍光X線分析計を用いた方法が土砂類中のヒ素や救命救急の分野で利用されている。
基準値例

利用方法
毒物としての印象が強いヒ素ではあるが、有効利用されている場面もある。半導体分野では、ヒ化ガリウムなどの形で発光ダイオード、モバイル機器などに使用されている。医薬品では、亜ヒ酸パスタ、三酸化二ヒ素として日本薬局方に収載されており、歯髄失活剤や急性前骨髄球性白血病治療剤として使用される。梅毒の特効薬として使用されていたこともある。通常の食事による摂取で充足し、欠乏症がみられることはまずないが、人体にとってヒ素は微量必須元素とも言われている。また、国内ではヒ素を有効成分とする農薬は現在登録されていないが、かつては殺虫剤として使用されていたこともある。
使用方法、使用濃度、使用環境などを正しく管理して使用することで、単なる毒物としてではなく、有効な利用も可能となる。
参考文献
|








