|
乳酸菌のワクチンへの利用
昭和女子大学 食健康科学部 管理栄養学科 専任講師 桝田 和彌 1. はじめに乳酸菌という名前を聞くとヨーグルト、チーズ、乳酸菌飲料などを思い浮かべる方が多いのではないかと思います。乳酸菌は糖類を分解して最終産物として多量の乳酸を産生する細菌です。この乳酸を産生する乳酸発酵を利用することで、古くから我々人類は数多くの発酵食品を作り、食してきました。近年では、発酵食品だけでなくチョコレートやふりかけなど、発酵食品以外の様々な食品に乳酸菌が添加された製品も見受けられます。これは乳酸菌のヒトへの健康効果を期待したものといえます。一部の乳酸菌は適切な量を摂取することで人に様々な健康上の利益をもたらすと考えられ、例えば腸内細菌叢の正常化、免疫細胞の活性化などの研究報告がされています1)。このように乳酸菌はその機能性により主に食品への利用が多くみられますが、食品以外でも乳酸菌の活用が考えられています。その1つが医薬品への応用であり、乳酸菌を用いた粘膜ワクチンの開発が検討されています。
2. 全身性免疫と粘膜免疫ワクチンは病原微生物による感染症への対策として用いられています。これはヒトの免疫機能を利用したものです。ヒトの免疫には血液や脾臓などを介した全身性の免疫と鼻や口、消化管といった粘膜面で機能する粘膜免疫があります(図1)。ワクチンの投与方法は、その種類によりますが、主に皮下注射や筋肉注射による接種が一般的です。この注射によるワクチン接種は、血中へワクチン抗原特異的なIgG抗体の産生を促し、また抗原特異的なT細胞の応答などを介して、液性免疫や細胞性免疫を誘導することができます。その結果、感染した病原微生物や感染細胞を効率よく排除することが可能になり、症状の重症化を抑えることができると考えられています。このように注射によるワクチン接種は感染症の重症化予防について大きな効果が期待できるものの、多くの感染症を引き起こす病原微生物の侵入口となる粘膜面への免疫誘導に関しては弱く、病原微生物の感染を予防することは困難であると考えられています。そのため、病原微生物の感染を予防するには、侵入口となる粘膜面に免疫を誘導することが重要になります。粘膜に免疫を誘導するにはワクチンの投与経路が重要であり、ワクチンを吸入または経口摂取することで、鼻の粘膜や消化管の粘膜から接種することが必要です。このような粘膜経由のワクチン接種は、粘膜面に免疫を誘導するだけでなく、血中の抗体産生誘導をはじめとした全身性の免疫も誘導可能であることから、粘膜ワクチンは感染初期段階の防御及び感染症の重症化の予防も期待されます2)。2024年から日本でも使用が開始された鼻にスプレーするタイプのインフルエンザワクチンは粘膜ワクチンの1例です。 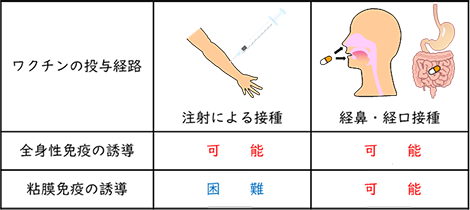 図1 ワクチンの投与経路と誘導される免疫
3. 乳酸菌をワクチン抗原運搬体とした経口ワクチン前述した通り、粘膜ワクチンはその効果が高く、特にワクチンを経口摂取する経口ワクチンは、投与に専門家が不要である点などから、開発が期待されるものの、実用的な経口ワクチンは限られています。これはワクチンが消化管を通過する必要があることが原因と考えられます。例えば、単純にワクチン単体を経口摂取すると、ワクチンが消化管で分解されることや、吸収効率の低下によって、粘膜免疫を誘導することができません。また、常に食品などの異物に曝されている消化管は免疫寛容が誘導されるため、摂取したワクチンによって腸管免疫を十分に刺激できず、病原微生物を防御できるほどの免疫を誘導することが困難であると考えられています。そのため、経口ワクチンの実用化には、ワクチンにとって過酷な環境といえる消化管内で十分に免疫を刺激できるような、ワクチンの機能を補助する運搬体が重要と考えられています3)。その候補の一つが乳酸菌です(図2)。 ワクチンの運搬体は経口的に摂取することから安全性が重要になりますが、乳酸菌は古くからの食経験により安全性が高いと考えられ、米国食品医薬品局によりgenerally regarded as safe(GRAS:一般に安全とみなされている)とされています4)。また、菌株によってはワクチンの機能を増強するアジュバントとして作用するものも知られています5)。このような機能をもつ乳酸菌を選抜し、遺伝子組換えによってワクチン抗原を乳酸菌自身に作らせることで、培養した菌株が経口ワクチンとして機能することが期待されます。これまでに様々な乳酸菌やワクチン抗原を用いた例が報告されていますが、本稿では、腸管免疫を介して子宮頸がんの前がん病変を治療する(がん免疫療法)ことを目的とした乳酸菌ワクチンの事例をご紹介します。  図2 抗原運搬体としての遺伝子組換え乳酸菌モデル
4. 子宮頸部異形成治療用ワクチンのデザイン子宮頸がんは子宮頸部に発生する癌で、世界的に4番目に多い女性のがんと考えられています6)。子宮頸がんの多くは、高リスク型のヒトパピローマウイルス(HPV)の持続的な感染によって発生すると考えられています。HPVへの感染は多くの場合、ウイルスは排除され自然治癒するものの、持続感染した一部の人では子宮頸部異形成(軽度異形成、中等度異形成、高度異形成の3段階)と呼ばれる前がん病変を経て、子宮頸がんへ進行すると考えられています。病状が進行した場合の主な治療法は外科手術ですが、若年女性では手術による妊孕能への影響が懸念されるため、外科手術以外の治療法が求められています。そこで、がん免疫療法の一つとして、子宮頸がん前がん病変に対する治療用ワクチン(がんワクチン)への乳酸菌の利用が検討されています。 がんワクチンは、がん細胞に特異的に発現する標的抗原を投与することで宿主の特異的免疫を誘導し、宿主の免疫細胞によってがん細胞を排除する方法です。子宮頸がんの前がん病変では、HPVに由来するE7というタンパク質が高発現することが知られているため、E7をワクチンとして投与することでE7特異的な細胞性免疫を誘導し、前がん病変の排除が期待されます(図3)。しかし、E7を皮下注射や筋肉注射で接種した場合、血中にE7特異的細胞性免疫は誘導されるものの、有効性が低く、臨床応用された薬剤はありません7)。また、HPVの侵入口となるのは性器粘膜ですが、この粘膜には免疫誘導組織が存在しないため、直接粘膜免疫を誘導することはできません。性器粘膜に免疫を誘導するには、ワクチンによって腸管免疫を刺激することが必要になります。腸管免疫は、小腸のパイエル板が腸管内の抗原を取り込むことで惹起されます。このとき、腸管で誘導されたリンパ球はその場にとどまらず、全身の粘膜に移動していきます。その移動先の一つが性器粘膜です。従って、子宮頸がん前がん病変の治療用ワクチンを経口的に接種することで、腸管免疫を介して病変のある膣内へ移動し、そこに発現するE7を特異的に認識し、がん細胞を排除する免疫担当細胞を誘導することが期待されます(図4)。 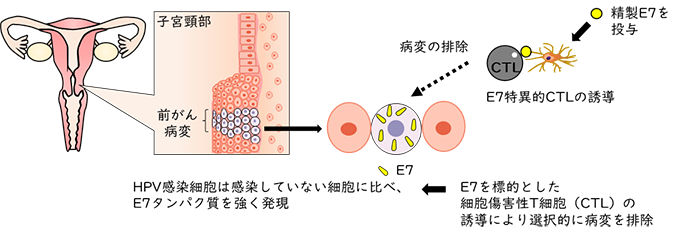 図3 子宮頸がん前がん病変に対する治療用ワクチン
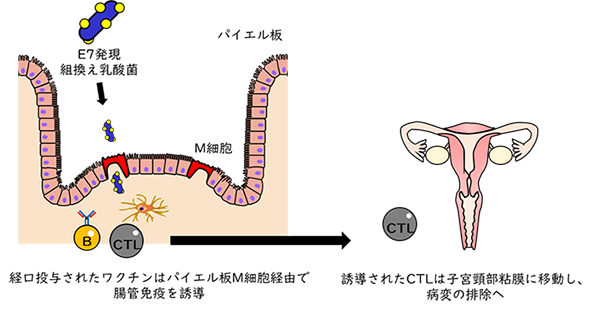 図4 腸管免疫を介した子宮頸部へのCTLの移動
5. HPV16E7を発現する組換え乳酸菌の作出、効果精製したE7タンパク質をそのまま経口摂取しても腸管免疫の誘導は困難であることから、乳酸菌の遺伝子組換えによりE7を菌体表層に発現する組換え乳酸菌が作出され、動物実験によりE7特異的細胞傷害性T細胞の誘導能の評価が行われています8)。この報告では、E7を発現する組換え乳酸菌をマウスに経口投与した結果、E7タンパク質を注射で投与するよりも腸管粘膜でより強くE7特異的な細胞傷害性T細胞を誘導することが示唆されました。この乳酸菌は子宮頸がん前がん病変患者を対象とした臨床研究に用いられ、大量投与群では高度異形成まで進行した病変の退縮が確認されました。このことからE7発現乳酸菌は、経口投与により治療用ワクチンとして機能することが示されました9)。この菌株は効果を発揮するのに大量の投与が必要であったことから、筆者らは免疫誘導に必要な抗原量の調整やE7の発現に用いるプラスミドや宿主を変更した改良型組換え乳酸菌を作出しました。この菌株をマウスに投与した結果、以前の乳酸菌株に比べ、腸管上皮リンパ球におけるE7特異的インターフェロンγ産生細胞数の有意な増加が確認されました。このことから作出した菌株がE7特異的な粘膜免疫応答を誘導する効果をもつことが示唆されました。(図5)10)。現在、この菌株を用いたヒト臨床治験が進められています11)。 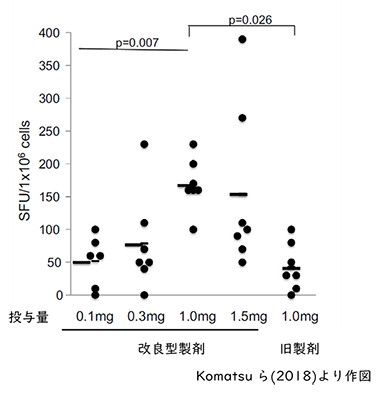 図5 E7発現組換え乳酸菌を投与されたマウス腸管上皮リンパ球におけるE7特異的インターフェロンγ産生細胞数
6. おわりにこれまでに乳酸菌をワクチン抗原の運搬体として用いた研究は数多く報告されているものの、実用化には至っていません。今回紹介した子宮頸がん前がん病変治療用の乳酸菌ワクチンのような臨床治験まで進む例は珍しいといえます。これは腸管免疫の誘導の困難さが大きいものと考えられます。現状としては乳酸菌に発現させるワクチン抗原の免疫原性に依存するところが大きく、抗原特異的な細胞性免疫は誘導できるものの液性免疫の誘導が困難であることなど、汎用的な乳酸菌経口ワクチンの開発には課題が残されており、改善方法が模索されています。近年、腸管内の抗原の取り込みに関わるパイエル坂M細胞の働きが明らかになってきたこともあり、M細胞を標的としたデリバリーシステムも検討されてきています。腸管内では主にM細胞から免疫担当細胞へ抗原が受け渡され免疫が惹起されることから、ワクチンをM細胞へ選択的に送達することができれば、効率の良い免疫誘導が可能になると考えられます。現在、さまざまな感染症の流行がみられますが、そのような感染症にも対応できるような、簡便で副反応が少ない、汎用的な乳酸菌を利用した経口粘膜ワクチンの実用化が期待されます。
文献
略歴
桝田 和彌
岐阜大学大学院連合獣医学研究科獣医学専攻博士課程修了後、国立医薬品食品衛生研究所、東京農業大学での博士研究員を経て、2017年より現職 サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |


