|
イオンクロマトグラフィーを用いた中心炭素代謝における
主要代謝物の測定と酒類の醸造への応用 高知大学 理工学部 化学生命理工学科 准教授 小崎 大輔 1. はじめに米欧日の研究チームにより、酵母S288C株の全塩基配列が解読されて以降、食品、バイオ、エネルギー、創薬分野などでの酵母開発が活発化し、今後は開発速度に合わせた各分野での効率的実装が求められる1-3)。一方、新規酵母は発酵特性に関する知見も少なく、頒布時に開発機関が主要な情報以外の詳細を付していないこともあり、酵母利用の多い醸造分野でも開発から利用までが律速になっている4)。 以上のことから、効率的な新規酵母の実装のためには、事前の酵母の発酵特性評価と、その評価結果から目的成分の効率的な生産制御を達成できることが重要となる。以上を踏まえ、醸造分野に注目した場合、デンプンからアルコールと酸までの主要な発酵反応は(A)糖化、(B)解糖系、(C)アルコール発酵、(D)クエン酸回路であり(図1)、そこから生産される成分の評価には、オリゴ糖、単糖、エタノール、ピルビン酸、その他の有機酸の効率的分析が必要になる。また、試料は酵素による変化があるため、原則、同時分析が望ましい。 上記の(A)~(D)の代謝反応の内、(B)~(D)は中心炭素代謝と呼ばれ、近年では代謝物の網羅的解析(メタボローム解析)における主要な解析対象となっている。一般的に、メタボローム解析では、液体クロマトグラフ(LC)やガスクロマトグラフ(GC)、キャピラリー電気泳動(CE)と質量分析装置(MS)や飛行時間型MS(TOF-MS)を連結した装置(GC/MSやLC/MS、CE/MS、CE/TOF-MSなど)が様々に使用されているが、本稿では、より広範な分野での簡易的な代謝物解析を目指し、LCと電気伝導度検出器(CD)及び示差屈折率検出器(RID)を組み合わせた、MSを用いない同時分離定量法について紹介する5-8)。
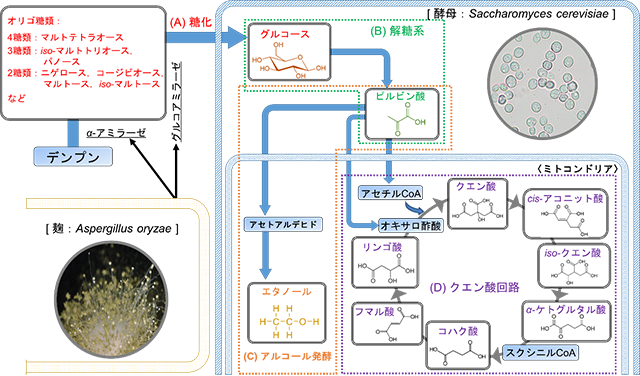 図1 日本酒醸造におけるデンプンからエタノール及び有機酸への代謝反応
2. 代謝物(オリゴ糖、単糖、エタノール、有機酸)の同時分離オリゴ糖、単糖、エタノール、有機酸の分離の達成を目的に、使用した装置構成(図2)及び分離機構(図3)は以下の通りである8)。 分離カラム(固定相)には、ポリメタクリレート基材にスルホ基が修飾された2本の低分子量サイズ排除カラム(Shodex製SH-1011,排除限界分子量1000 M.W.)及び2本の中分子量サイズ排除カラム(Shodex製SH-1821,排除限界分子量: 10000 M.W.)を用いた。 溶離液(移動相)には、4.5 mMフタル酸水溶液を用いた。
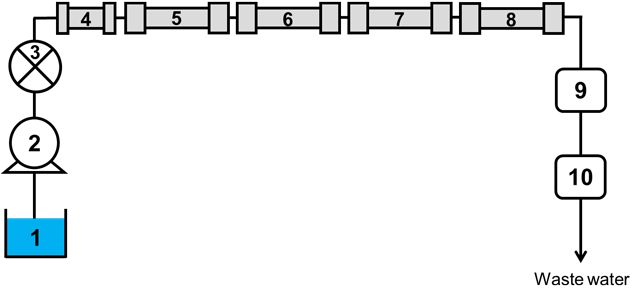 図2 オリゴ糖、単糖、エタノール、有機酸の分離を目的に、使用した装置の構成 1:4.5 mMフタル酸溶離液、2:送液ポンプ、3:試料注入器、4:ガードカラム(Shodex製SH-G) その際に発現される分離機構は以下の通りである。 中性成分である糖の分離には、図3(a)に示すように、分子量に基づいて分離されるサイズ排除分離(SEC)が働いている。分子量の小さい成分は細孔の深くまで浸透する一方、分子量の大きい成分は細孔に浅く浸透するもしくは、浸透することなく、カラム内を通過する。そのため、単糖と比較して分子量の大きいオリゴ糖の保持時間が短くなる。 有機酸のような陰イオンの分離には、図3(b)に示すように、イオン排除分離(IEC)が働いている。弱酸性の陰イオンの場合、酸性移動相中の水素イオンにより解離が抑制されるため、陽イオン交換樹脂に修飾されている交換基(スルホ基)との反発が小さくなることで負電荷相に浸透することができ、保持時間が長くなる。一方、強酸性の陰イオンは酸性移動相中においても完全解離しており、交換基との反発が大きく負電荷相に浸透することができず保持時間が短くなる。つまり、有機酸(陰イオン)に関しては、そのpKaの値に依存して分離される。 エタノール及び有機酸の分離には、図3(c)に示すように、分析対象成分の疎水性の度合いに基づいて分離を行う逆相分離(RPC)が(も)働いている。本研究で用いたカラムはスチレンジビニルベンゼン共重合体を基材としており、疎水性の高い成分ほど固定相に長く保持される。弱酸性の陰イオンやエタノールはカラムの基材に近づくことで微量ながら疎水性相互作用の影響を受けるものと推測される。 これらの3つの原理を組み合わせることで、日本酒中の主要代謝物21成分(マルトテトラオース、iso-マルトトリオース、パノース、ニゲロース、コージビオース、マルトース、イソマルトース、グルコース、ガラクトース、キシロース、マンニトール、アラビノース、ピルビン酸、クエン酸、cis-アコニット酸、iso-クエン酸、α-ケトグルタル酸、コハク酸、フマル酸、リンゴ酸、エタノール)の分離を試みた。
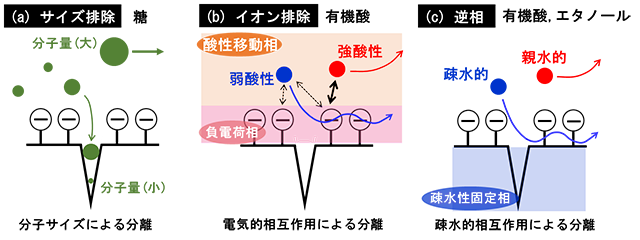 図3 用いた分離原理と分析対象成分との組み合わせ
その結果、図4に示すような分離が得られた8)。 オリゴ糖に関しては、糖鎖長が同じオリゴ糖に関する分離は達成されなかったものの、同じ糖鎖長のオリゴ糖の場合、濃度当たりの検出感度がほぼ同様であったことから、オリゴ糖の鎖長ごとの濃度の定量が可能であった。 単糖及びアルコールに関しては、グルコース及びエタノールに加え、マンニトール、アラビノースの分離が達成された。 有機酸の分離に関しては、cis-アコニット酸、α-ケトグルタル酸、ピルビン酸、クエン酸、iso-クエン酸、L-リンゴ酸、フマル酸、コハク酸の分離が達成された。(実試料分析においては、cis-アコニット酸及びα-ケトグルタル酸が他の夾雑成分の保持時間と重複し、定量が不可能であった。) 以上の結果を纏めると、2~4糖の鎖長別分離に加え、10種の単糖、有機酸、エタノールの分離が達成された。
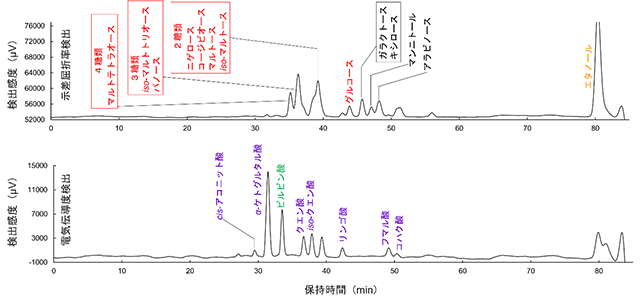 図4 日本酒醸造において生じた主要代謝物の分離のためのLC-CD/RIDを用いたクロマトグラム
3. 日本酒醸造における工程管理への応用本法を用い、高知県内酒蔵より、醸造日数ごとに採取した15サンプルの分析を行った。その結果、図5に示すように、各分析対象成分の濃度変動が明瞭にモニタリング可能であった8)。 特に、図5(A)に示すように、醸造3日目から20日目にかけて、グルコースの濃度が減少(10.0~1.62 w/v%)する一方、エタノールは増大(4.23~17.2 %)する傾向を示した。これは、前述のとおり、デンプンの(A)糖化により供給されていたグルコースが(B)解糖系、(C)アルコール発酵、(D)クエン酸回路によって消費される一方、エタノールが(B)解糖系及び(C)アルコール発酵を経て生産されたことに由来している。 4糖類~単糖を見た場合、その濃度はグルコース>2糖類>3糖類>4糖類となっており、2~4糖類に関しては、麹菌由来のグルコアミラーゼにより徐々に濃度が減少した。 また、図5(B)に示すように、解糖系によって生じるピルビン酸は、グルコースの供給が十分な醸造序盤は一時的に濃度が高く保たれるものの、グルコース濃度の減少に伴い、その供給が減ることで、自身の濃度も(C)アルコール発酵及び(D)クエン酸回路によって消費され、減少する傾向を示した。 本稿ではクエン酸回路に由来する有機酸の中でも、明瞭な定量が可能であったクエン酸、L-リンゴ酸、コハク酸について述べる。図5(B)に示すように、各有機酸は、クエン酸回路の進行に伴い、濃度が増大する傾向を示した。また、醸造10日目において、有機酸を含む、全ての分析対象成分の濃度の減少が見られたが、これに関しては、アルコール度数の制御を目的とした酒造時の加水によるものである。 加えて、通常、ピルビン酸は日本酒においてネガティブな印象を与えるヨーグルト臭の発生の原因になる事から、200~100 mg/Lを下回ることが望ましい。本法を用いることにより、分析対象成分の濃度変動の把握に加え、加水時期やピルビン酸の濃度減少を把握しながら搾りへの移行が可能となる。
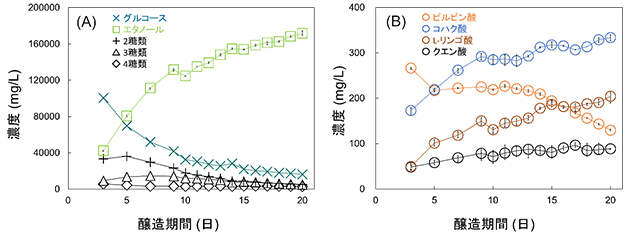 図5 醸造過程における日本酒試料中の分析対象成分の濃度変動に関するモニタリング
4. おわりに以上のように、LC-CD/RIDと分離機構の複合的な発現(本稿ではSEC/IEC/RPC)により、(A)糖化、(B)解糖系、(C)アルコール発酵、(D)クエン酸回路における主要な代謝物に限定されはするものの、MSを用いずとも、反応の進行が解析可能である。このような手法の開発により、現在、GC/MSやLC/MS、CE/MS、CE/TOF-MSのような高額機器が主役となっているメタボローム解析において、上記の機器から考えると比較的、安価な機器を用いた主要代謝物解析が可能になる。 今後、本稿で解説したような手法を用い、メタボローム解析の技術が一部の研究機関や大学、企業に留まらず、広範な分野において普及し、延いては国内の企業を含む様々な分野の研究・開発力の底上げに寄与する可能性を期待している。
参考文献
略歴
小崎 大輔(こざき だいすけ)
2012年3月 広島大学大学院にて博士(工学)を取得後、(独)日本学術振興会/特別研究員(DC2)、Universiti Malaysia Pahang/Senior Lectorを経て現在は高知大学 理工学部 化学生命理工学科/准教授 サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |


