|
サルモネラ感染症 ~病原因子と発症メカニズム~
学校法人北里研究所 理事 北里大学 名誉教授 岡田 信彦 1. はじめにサルモネラ属菌(Salmonella enterica)は、腸内細菌科に属するグラム陰性通性嫌気性桿菌で、主にヒトや動物の消化管に生息する腸内細菌である。現在、約2,500種の血清型が知られ、一部は宿主に対して病原性を示す。ヒトに病原性を持つサルモネラは、重篤な全身感染症(チフス性疾患)を引き起こすチフス菌とパラチフス菌のほか、食中毒など局所感染を引き起こす非チフス性サルモネラに分類される。非チフス性サルモネラの代表的な血清型には、ネズミチフス菌および腸炎菌などが知られている。食中毒によるサルモネラ感染症の病態は、急性胃腸炎(下痢症)であり、通性細胞内寄生性細菌であるサルモネラは、粘膜組織侵入型の感染により腸炎を引き起こす。 今回は、サルモネラ腸炎の発症メカニズムについて、細菌の病原因子及び宿主の生体防御機構との相互作用から、私たちの研究成果を踏まえ説明する。
2. マウス腸炎モデルの確立とサルモネラ腸炎発症機構の解析サルモネラ腸炎の in vivo 解析においては、マウス腸炎モデルが確立されている1)。マウスにストレプトマイシン(抗生物質)を前日投与し、サルモネラ(ネズミチフス菌)を胃内投与すると、24時間以内に腸炎を引き起こす。このマウス感染モデルが確立して以降、サルモネラ腸炎に関与する病原因子の機能および宿主応答について、多くの解析データが蓄積されてきた。 サルモネラは、Salmonella pathogenicity island(SPI)-1とSPI-2にコードされる2つの異なるⅢ型タンパク質分泌機構(type III secretion system;T3SS)、すなわち、T3SS-1とT3SS-2を有する。T3SS-1およびT3SS-2から分泌されるⅢ型エフェクター(病原因子)を介して、サルモネラは、細胞侵入性、宿主細胞内での生存、宿主免疫応答の撹乱、細胞死誘導など、多彩な機能を発現する(図1)。また、サルモネラ腸炎モデルにおいて、これらのⅢ型エフェクターが、サルモネラ腸炎の発症に大きく関与することが明らかとなっている。
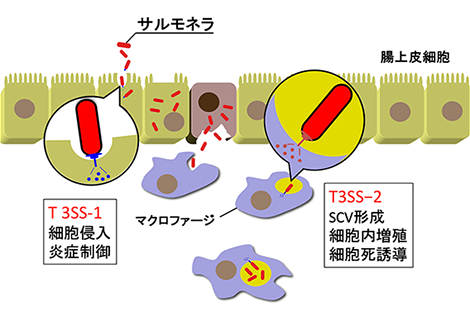 図1 サルモネラSPI -1 T3SS (T3SS-1)とSPI -2 T3SS (T3SS-2)
マウス腸炎モデルにおいて、胃内投与6〜10時間後に、サルモネラは盲腸の腸管粘膜に定着し、上皮細胞に侵入する。このとき、サルモネラが分泌するⅢ型エフェクターが初期炎症応答のスイッチとして働く。48〜72時間後、腸管粘膜においてサルモネラが増殖することで、宿主の自然免疫が誘導され、さらに広範に炎症応答が増強される。病理組織学的には、粘膜の水腫、白血球の浸潤、上皮細胞の剥離などの所見が観察される。また、サルモネラは、腸管粘膜に炎症を誘導することで腸内細菌を撹乱し、ディスバイオーシスを引き起こす。すなわち、サルモネラによる炎症誘導は、腸管のバリアー機能を無効としサルモネラが腸管で有利に増殖あるいは定着するために必要な過程の1つである。
3. サルモネラT3SS-1Ⅲ型エフェクターを介した細胞侵入と炎症制御機構経口的に摂取されたサルモネラが腸管粘膜に達すると、T3SS-1により、細胞侵入に関わるⅢ型エフェクター(SipA、SopE/SopE2、SptPなど)が腸管上皮細胞に分泌され、さまざまな細胞反応が誘起される2)。SipAは、宿主細胞に注入されると細胞質内のアクチンに結合してアクチンの重合化を安定化させる。SopE/SopE2は、グアニンヌクレオチド交換因子で、低分子量GTPaseであるCdc42およびRac1をGDP型からGTP型に変換し活性化する。これにより、アクチン重合が亢進し、ラッフル膜の形成によりマクロピノサイト−シス(細菌の飲込み運動)が誘導され、サルモネラは宿主細胞内に取り込まれる。一方、SptPは、GTPase 不活性化因子で、低分子量GTPaseをGTP型からGDP 型に加水分解することで不活性化する。したがって、サルモネラが宿主細胞内に取り込まれると、SptPは一連の反応を終結し、正常なアクチン骨格へと戻す役割を持つ。 サルモネラの細胞侵入過程において、SopEはカスパーゼ1の活性化を誘導し、インターロイキン-1β(IL-1β)およびIL-18前駆体が限定分解され、成熟型 IL-1βおよび IL-18として細胞外に分泌される。これらのサイトカインによりサルモネラ感染に対する初期炎症応答が惹起される3)。一方、サルモネラにより誘導された炎症反応は、サルモネラが分泌する炎症抑制エフェクター(AvrA、SpvC、SptP、SseK1など)により抑制される4)。AvrAは、アセチル転移酵素活性を持ち、MEKを標的としてアセチル化修飾することでMAPキナーゼの1つであるJNKによるシグナル経路を不活化する。その結果、炎症性サイトカインの産生を抑制するとともに、カスパーゼ−3の活性化を抑制し、アポトーシス誘導を阻害する。SpvCは、リン酸化スレオニン脱リン酸化酵素活性を持ち、リン酸化MAPキナーゼ(ERK1/2、p38、JNK)を脱リン酸化することでMAPキナーゼにより活性化される下流のシグナル経路を抑制する。マウス腸炎モデルによる感染実験では、spvCを欠失したサルモネラ変異株は、感染24時間後、感染部位である盲腸粘膜において、粘膜下組織の広範な炎症反応を惹起し、また、抗リン酸化ERK1/2抗体による免疫染色では、腸管上皮細胞において強い抗体陽性反応が観察された(図2)。さらに、炎症性サイトカインの発現が有意に上昇していた5)。すなわち、サルモネラは、宿主の炎症反応を誘導した後、一方で免疫応答を抑制し、感染部位における増殖環境を確保し腸粘膜での増殖を進めるものと考えられる。
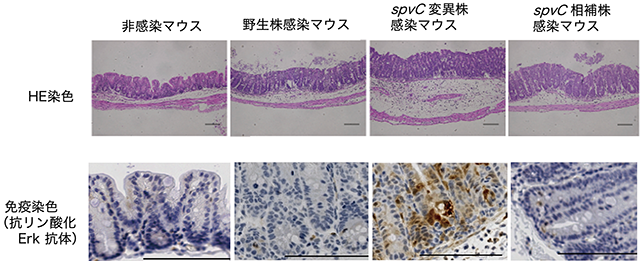 図2 サルモネラ腸炎モデルを用いたSpvCによる炎症抑制効果の病理学的解析(文献5より改変)
4.サルモネラⅢ型分泌装置の構築と宿主ポリアミンサルモネラは、Ⅲ型分泌装置の構築に宿主のポリアミンを利用し、宿主感染性を促進する6)。ポリアミンは、アミノ基を 2つ以上持つ炭化水素であり、代表的なものにはプトレッシン、スペルミジン、スペルミンが知られている。宿主からのポリアミンの取り込みができないサルモネラ変異株は、正常なⅢ型分泌装置を構築できず(図3)、マウスに対する感染性が著しく低下する。宿主のポリアミン合成阻害薬であるエフロルニチンを飲水させたマウスでは、サルモネラの感染性は減弱したが、スペルミジン飲水マウスでは感染性が上昇した。さらに、サルモネラは アルギナーゼの活性を亢進させ、L -アルギニンを L -オルニチンと尿素に加水分解し、宿主のポリアミン量を上昇させ、感染に有利な環境を作り上げていることが明らかとなった。このように、サルモネラは、宿主由来の因子を利用して感染性をより強くしていることもわかってきた。
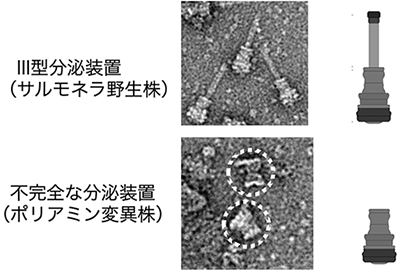 図3サルモネラ野生型およびポリアミン変異株より精製したIII型分泌装置の電子顕微鏡像と模式図。ポリアミン変異株より精製された点線円内に示されたIII型分泌装置は、基部体のみの不完全なIII型分泌装置が観察された(文献6より改変)。
5. サルモネラT3SS-2Ⅲ型エフェクターを介した細胞内増殖と炎症制御機構サルモネラT3SS-2による腸管粘膜の炎症誘導は、T3SS-1変異株を用いたマウス腸炎モデル感染実験によって明らかにされている7)。T3SS-2のみを発現するT3SS-1変異株は、経口投与後48〜72時間にかけて盲腸の腸粘膜において重篤な腸炎を引き起こす。 T3SS-1変異株においては、SPI-1Ⅲ型分泌機構を介した腸上皮細胞への侵入はできないものの、盲腸ろ胞被覆上皮を介したリンパろ胞組織への取り込み、上皮細胞間からの侵入および樹状細胞による腸管管腔のサルモネラの取り込みなどにより、管腔から上皮下へ侵入するものと考えられている(図1参照)。粘膜固有層に達したサルモネラは、マクロファージに取り込まれ、細胞内で増殖する。マクロファージのファゴソーム内に存在するサルモネラは、T3SS-2の発現誘導により、Ⅲ型エフェクターを宿主細胞の細胞質に分泌し、サルモネラ特異的な小胞膜、サルモネラ小胞(Salmonella -containing vesicle、SCV)を形成する。SCVの形成は、種々の殺菌成分を含むリソゾームとの融合を阻害し、小胞内でのサルモネラの生存と増殖を促進する。一方、粘膜固有層のサルモネラにより宿主の初期生体防御反応として自然免疫が活性化し、Ⅰ型インターフェロン、炎症性サイトカインおよびケモカインの産生が促進し強い炎症反応が誘導されるが、サルモネラは、T3SS-2を介して、GogA、PipA、GtgA、SpvDなど抗炎症作用を持つⅢ型エフェクターを分泌することで宿主応答からの殺菌機構を回避する。これらの炎症抑制エフェクターは、いずれもNF-κB経路の活性化を阻害する。GogA、PipAおよびGtgAは、メタロプロテアーゼ活性を有し、NF-κB p65(RelA)とNF-κB p55(RelB)を切断することで、NF-κB経路を介して活性化する炎症性サイトカインの発現を阻害する。SpvDは、p65の核内移行に必要なインポーチンαの核から細胞質へのリサイクルを阻害することにより、p65の核内移行を遮断し、結果としてNF-κB経路からのサイトカイン産生を抑制する。 このように、サルモネラは、炎症反応が過剰にならないよう炎症を抑制し、宿主の生体防御機構からエスケープすることで腸粘膜において増殖し、一部は、腸管組織から腸間膜リンパ節、さらには脾臓や肝臓に移行する。
6. おわりにサルモネラは、Ⅲ型分泌装置により分泌される種々のⅢ型エフェクターを駆使して、宿主からのサイトカインやケモカインの産生を誘導あるいは抑制し、宿主の生体防御機構を制御する。一方、サルモネラの感染成立には、マイクロビオータ(腸内細菌叢)を形成する腸内細菌との関わりが強く示唆されている。したがって、サルモネラー宿主生体防御機構―腸内細菌における3者の相互作用を考慮し、サルモネラがどのように感染を成立させるのかさらに詳細な解析が必要となっている。今後、サルモネラ感染症による予防法や治療法を確立し、食の安全を確立するためにも、サルモネラ感染症における発症メカニズムの詳細について解析が進むことを期待したい。
参考文献
略歴
岡田 信彦
1987年 東京大学大学院農学研究科博士課程修了。同年 東京大学医科学研究所助手、1993年〜1995年 米国ワシントン大学(セントルイス)留学、1997年 北里大学薬学部助教授(2007年 准教授)、2010年 北里大学薬学部教授、2018年〜2022年 北里大学薬学部長、学校法人北里研究所理事、2024年 定年退職、北里大学名誉教授、2024年 学校法人北里研究所理事、現在に至る。 サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |


