|
フルクトース誘導性の脂肪肝に対するミオイノシトールの予防作用
岐阜大学 応用生物科学部
准教授 島田 昌也 1. はじめに -ミオイノシトールの抗脂肪肝作用- 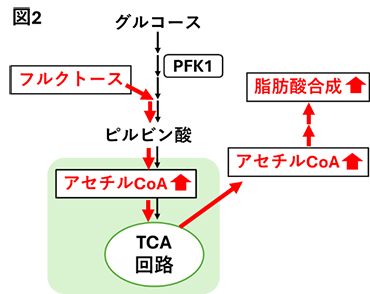
2. フルクトースの過剰摂取が誘導する脂肪肝に対するミオイノシトールの予防作用先にも述べたが、解糖系の律速酵素PFK1をバイパスしたフルクトースは、フルクトース分解に関与する酵素ketohexokinase(KHK)、aldolase B(ALDOB)などの作用を受け、脂肪酸合成さらにはTAG合成・蓄積へ向かう経路を活性化させる。私たちは、ラットにフルクトースを短期間過剰に摂取(高フルクトース食を摂取)させ脂肪肝を誘導する際にMIを補充し、肝臓TAG蓄積に及ぼす影響を検討した。その結果、MIは肝臓TAG蓄積を著しく低下させることに加え、上流のフルクトース分解系から脂肪酸合成、さらには中性脂肪合成の初期段階の経路までを抑制する可能性を、定量リアルタイムPCRやイムノブロットによる発現解析により明らかにした(図3)[4、5]。 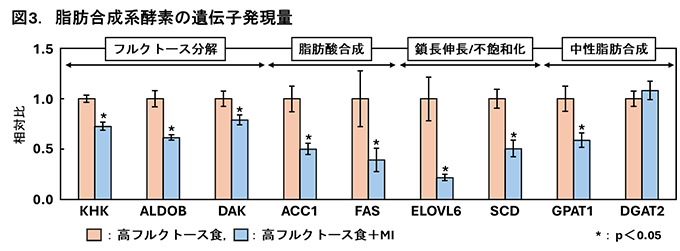 このような脂肪合成に関与する酵素の遺伝子発現を制御する転写因子には、一般的にグルコースの流入によって活性化されるcarbohydrate-responsive-element-binding protein(ChREBP)および摂食時に分泌されるインスリンによって活性化されるsterol regulatory element-binding protein-1c(SREBP-1c)の二つがあり、これらが協調して作用する[6]。ChREBPは標的遺伝子プロモーターのcarbohydrate response element(ChoRE)に結合し、またSREBP-1cは標的遺伝子プロモーターのsterol regulatory elements(SRE) に結合し、標的遺伝子の発現を上方調節する[6]。そこで、MIによる脂肪合成系酵素の遺伝子発現の低下には、ChREBPとSREBP-1cのどちらかあるいは双方が影響するのかを検討することとした。対象とした遺伝子は、脂肪酸の鎖長伸長に関与する酵素である 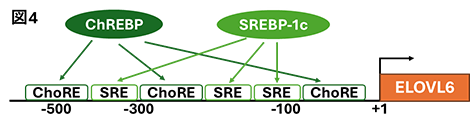 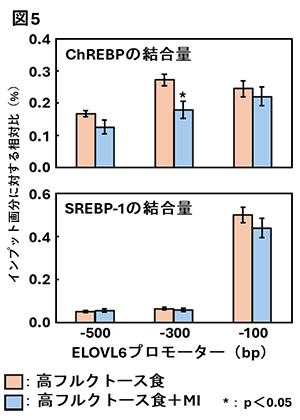 3. おわりに今回ご紹介させていただいた私たちのデータからは、あくまで遺伝子発現制御を中心としたMIの抗脂肪肝作用メカニズムの下流を少し明らかにできただけである。摂取したMIが肝臓に到達し抗脂肪肝作用を発揮するための初動シグナル(上流のメカニズム)は不明なままである。これに関する研究は現在進行中あり、今後の研究の進展を待たれたい。 参考文献
略歴島田 昌也 岐阜大学 応用生物科学部 准教授
静岡県立大学大学院生活健康科学研究科博士課程修了後、千葉県立保健医療大学健康科学部・助教、岐阜大学応用生物科学部・助教を経て、2015年4月より現職 サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |

