|
イネにおける植物ホルモンの受容とシグナル伝達
名古屋大学 生物機能開発利用研究センター
客員研究員 上口(田中) 美弥子 1.はじめに植物ホルモン、ジベレリンはそもそも、イネと菌との相互作用から日本人が発見したものである。1926年、台湾総督府農事試験場の技師である黒沢英一は、馬鹿苗病菌に罹患したイネが徒長することを見出し、また、それは馬鹿苗病菌が分泌した物質が原因であることも明らかにした1)。その後、この物質は植物全般に植物ホルモンとしても内在していることが明らかとなり、薮田貞治郎によってジベレリンと名付けられた2)。日本人によって命名された唯一の植物ホルモンでもある。第二次世界大戦後、世界中でジベレリン構造決定競争がされたが、あと一歩というところで、アメリカ・イギリスのグループが先んじて報告した。しかしながら、この構造決定とその後の様々なジベレリン類の構造決定に日本人研究者が重要な役割を果たしてきたことは間違いない。 ジベレリン(図1)は、発見の経緯からもわかるように、植物の伸長にかかわる植物ホルモンである。また、種子発芽、雌雄の決定、花芽形成、花粉形成といった植物の様々な成長段階で重要な働きを果たすことが知られている。作物の草丈は対倒伏性の制御として古くから育種目標の1つとなっていたし、大麦の発芽および種子アミラーゼの誘導に対する作用は、ビールやウィスキー製造に欠かせないものであった。このように、ジベレリン研究は、応用と基礎研究が表裏一体となって進んできた印象がある。本報では、ここ20年余りで急速に解明されてきたジベレリンの生合成ならびにシグナル伝達について、イネを中心にまとめる。
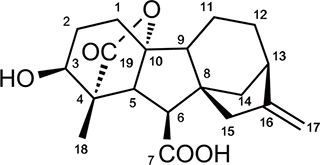 図1.活性型ジベレリンの1つGA4の構造
2.イネにおけるジベレリン関連変異体の表現型について20世紀中頃、小麦、とうもろこし、米といった主要穀類に対し、短稈化により肥料をたくさん与えても倒れず多収性を示すような育種が行われ、世界の飢餓が救われた。いわゆる緑の革命である。イネにおいては、イネの背の高さを制御する遺伝子領域であるSemi-dwarf1(sd1)座が広く用いられた。我々は、ポジショナルクローニングにより、SD1遺伝子がジベレリンGA20酸化酵素(ジベレリン生合成経路の最終から1つ前のステップを触媒する酵素)をコードしていることを明らかにした3)。ジベレリンの生合成ができないため、短稈化される一方で、同じステップの酵素が複数あるため適度な矮性度を示すことが、育種で選ばれた理由の1つであろう。一方で我々は、生合成の最終ステップを触媒する酵素を欠失したイネの変異体d18も単離、解析を行なった4)。こちらの酵素は、ほぼこの酵素1つがこのステップを担っていたため、欠損変異体は非常に矮性度が強かった。この欠損変異体は、濃緑葉で、幅広い葉の特徴を示す一方で、各節間どうしの比率は通常のイネと変わらなかった(すなわち普通のイネを縦方向にどの節間も等しく縮めたようなイメージ)。ここに至って、双子葉であるモデル植物シロイヌナズナでのみ観察することができたジベレリン欠損変異体が、ようやく単子葉植物でどのような特徴を持つのかということを理解できるようになったのである。その後、この欠損変異体と同じような特徴を持つイネ変異体から、生合成経路上の様々な酵素の欠損変異体とその原因遺伝子を明らかにすることができた5)。しかし、もっと重要なことは、ジベレリンの受容体やシグナル伝達の下流に位置する因子はシロイヌナズナにおいてさえ解っていなかったのであるが、その解明をイネ変異体を用いて行うことが可能になった点にある。なぜならば、これらのシグナル伝達変異体は、生合成変異体と酷似した特徴か、もしくは、真逆な特徴を持つと予想されたからである。 3.イネジベレリンシグナル伝達変異体の単離先の理由により、「濃緑色で幅広の葉を持つイネで節間長比が正常な極矮性イネ変異体を探し、ジベレリンを投与した時に応答しないもの、もしくは、真逆の形態・応答をするものを選び出す」という極めてストレートフォワードな方法で、イネからジベレリンシグナル伝達変異体を探すという課題に取り組むことになった。来る日も来る日も、変異源処理をしたイネ籾を撒いては、幼苗を観察、形態的に有望な苗があるとジベレリン応答をみていくという作業を温室で行っていった。そんな中で、極矮性のgibberellin insensitive dwarf1 (gid1)、およびgid2変異体を解析することとなった(図2)。一方で、池田亮氏らとの共同研究で、「緑の色が薄く、細い葉を持つ背の高いイネで、ジベレリン応答が過剰になっている変異体」slender1 (slr1)変異体の解析も並行して行っていた(図2)。
 図2.イネジベレリンシグナル伝達変異体(京大集中講義より改変)
4.イネ変異体を使ったジベレリンシグナル伝達の解析上記の3つのイネジベレリンシグナル伝達変異体の中で、最初に解析ができたのは、slr1変異体であった。機能欠損変異により徒長したイネになったので、本来のイネにおけるSLR1タンパク質の機能はジベレリンシグナル伝達の抑制因子であると考えられた。ポジショナルクローニングの結果解ったことは、意外なことにシロイヌナズナですでに報告されていた、gibberellin (GA) insensitive dwarf (GAI)というGRASファミリーに属する転写因子様タンパク質のホモログであったことである6)。なぜ、意外であったかというと、GAIは、シロイヌナズナにおいてジベレリン非感受性の矮性変異体の原因遺伝子であって7)、かたやSLR1は、徒長型イネ変異体の原因遺伝子であったからである。この一見矛盾する興味深い結果は、変異の箇所の違いによるものであることが後に解った。すなわち、シロイヌナズナのgai変異体は、N末の一部(DELLA領域)がin flameで抜けているのに対して、slr1変異体は、C末側に変異があることがわかった。また、我々やそれ以外の研究室から、ジベレリンを投与するとこれらのタンパク質が分解されて無くなるということも報告された。これら生化学的な実験結果と変異体の表現型を考え合わせて、ジベレリンシグナルがDELLA領域に伝えられると、GRASタンパク質が分解を受け、抑制が解除されるために植物が成長するという基本概念が提唱された。現在、N末側に配列特徴的なDELLA領域をもつGAI、SLR1といったGRASタンパク質を特にDELLAタンパク質といい、ジベレリンシグナル伝達において中心的役割を果たすことが解っている。 次に、我々は、gid1、gid2極矮性変異体の解析を行なった。変異体は、gid1、gid2の順で単離したのであるが、gid1の解析は難航を極めgid2変異体の正体が先に解ることになる。ポジショナルクローニングの結果、GID2は、標的タンパク質の分解に関わるF ボックスタンパク質であった8)。標的タンパク質とは何か?SLR1タンパク質ではないか?予想通りで、gid2変異体と普通のイネの中で、目印(GFP)をつけたSLR1を発現すると見事、gid2変異体の中では、SLR1が分解されないことが実験的に証明できたのである。 gid1変異体の原因遺伝子(GID1)の単離は、当時、助教で新しく赴任された芦苅基行氏(現:名古屋大学生物機能開発利用研究センター教授)を中心に行われた。GID1の単離には、ポジショナルクローニング法ばかりでなく、イネゲノム情報が大いに威力を発揮した。日本では、1991年からイネの全遺伝子情報解読に関する研究が開始され、97年には、世界9カ国1地域と共同プロジェクトが発足、日本はリーダーシップをとって、本プロジェクトを進めていた。2002年12月には、東京で稲ゲノム塩基配列解読の記念式典が行われ、当時の首相小泉純一郎氏が解読終了を宣言した。まさに、この時期、GID1の遺伝子がイネ染色体のどこにあるか、どんなタンパク質をコードしているかを探索していた訳で、まさにこの遺伝情報をアップツーデートに利用することができたことは、僥倖であった。 芦苅氏の抜きん出た能力と時代の幸運の中で、2003年ころまでにはgid1変異体は、5番染色体上にある、あるタンパク質をコードしている遺伝子(GID1)が壊れているためということがわかった。ところが、この質は、エステラーゼとよく似たタンパク質であるということで、また、研究は混迷を極めた。私は、GID1がDELLAタンパク質を基質とする酵素ではないかと考える時期もあったが、様々な実験結果は予想を否定するものばかりであった。ある日、この“エステラーゼ like”なタンパク質のアミノ酸配列をずっと眺めていると、酵素の活性に重要な触媒3残基「セリン―アスパラギン酸―ヒスチジン」が「セリン―アスパラギン酸―バリン」に替わっていることに気がついた。これでは触媒反応は不可能ではないか?基質(ジベレリン?)と結合するけれども酵素活性を引き起こせないジベレリン受容体なのではないかという妄想に至った。運は続くもので、そのころ、3年に一度開かれるIPGSA(International Conference on Plant Growth Substances Association『国際植物成長物質会議』)が、オーストラリアのキャンベラで開かれた。そこで、東京大学の薮田貞治郎先生 (ジベレリンを命名した) の門下でいらした山口五十麿先生と偶然お会いした。山口先生の研究室では、ジベレリン結合タンパク質の結合活性測定を助教の中嶋正敏 先生がされているとのことで、さっそく共同研究を申し入れた。日本に帰国後、リコンビナントGID1タンパク質を研究室にお持ちして約2週間後、『GID1にジベレリン結合活性がある』という内容のメールを受け取った時の喜びは、ひとしおであった。その後、中嶋先生とGID1がジベレリンの受容体であるということの証明にはどのような実験結果が必要かといったディスカッションの下、ジベレリンに対する解離定数、結合と乖離のスピード、リガンド特異性、変異タンパク質への非結合性などの測定を行っていただいたが、全ての結果はGID1がジベレリンの細胞内(核内)受容体であることを支持するものであった9)。 最後に、ジベレリンシグナル伝達の鍵因子、イネのDELLAタンパク質であるSLR1との関係性を明らかにする必要があった。遺伝学的には、gid1とslr1の2重変異体は、slr1変異体とまったく区別ができず、このことは、GID1とSLR1は、同じシグナル伝達上に存在し、GID1がシグナル伝達上、SLR1の上流に存在していることを示していた。そこで、最も単純な可能性、「GID1にジベレリンが結合するとSLR1に結合できるのではないか」と仮定し、ジベレリン有る無しの条件下でイースト・ツーハイブリッドによりGID1とSLR1の結合を調べたところ、予想通りジベレリン存在下でのみ、GID1とSLR1が結合することが示されたのであった9)。 以上のことから、ジベレリンシグナル伝達は、図3に示すように、ジベレリンが無い時には、SLR1は、植物の成長等、ジベレリン応答を抑制している。ジベレリンが有るとジベレリン受容体GID1がジベレリンと結合し、SLR1と結合できるようになる。SLR1はさらにGID2をはじめとするSCFGID2/SLEEPY複合体により認識、ユビキチン化され26S プロテアソームにより分解されることで、抑制が解除されてジベレリン応答が起こるという、ジベレリンシグナル伝達の基本概念を明らかにすることができた。その後、このシステムは、シダから被子植物まで共通に持っている仕組みであることも、いくつかの研究室から報告された10,11)。
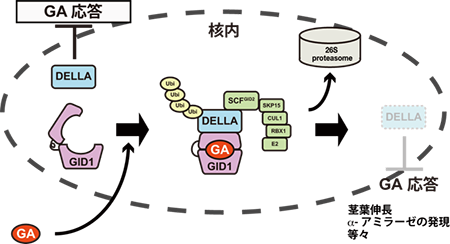 図3.ジベレリンシグナル伝達
さらに、私たちのグループ12)と奈良先端大学の箱島教授のグループ13)の同時発表により、GID1のX線結晶構造解析の結果が報告され、リパーゼとよく似た構造のGID1がその基質結合部位に相当する部位でジベレリンと結合していることが示された(図4)。すなわち、GID1は、酵素から進化した受容体であることが推定された。そして、ジベレリンが結合部位に結合するとN末側の部分が蓋状になって閉まり(Lid)、この蓋の上にDELLAタンパク質のDELLAドメインに結合することが、両グループから同時に発表された。ふりかえってみれば、それだからDELLAドメインを欠損したgai変異体はジベレリンシグナルを受け取れず、矮性変異体の形質を示したのだと納得した。現在、別な植物ホルモンであるステリゴラクトンの受容体もエステラーゼから進化したことが分かってきており、植物ホルモンの受容体の鋳型として、進化上幾度も利用されてきたのかもしれない。一方で、ステリゴラクトンの受容体の場合には、酵素活性が維持されており(=触媒3残基は受容体でも保存されている)、触媒作用を受けることがステリゴラクトンの受容には必須である。したがって、そのエステラーゼの受容体としての利用はいくつか独立した進化の道筋を経たと考えられ、大変興味深い。
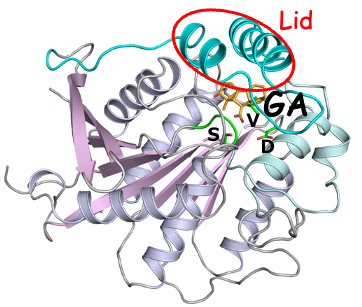 図4. イネGID1ジベレリン受容体の構造
5.DELLAタンパク質(イネSLR1やシロイヌナズナGAIやRGAなど)の消失がジベレリン応答を引き起こす仕組みDELLAの機能については、現在も様々な論文が出されている。そもそも、ジベレリンを与える(=DELLAタンパク質が無くなる)と、植物の伸長に関わる様々な遺伝子の発現が上がる一方で、ジベレリンを減らす(=DELLAタンパク質を増やす)と、ジベレリン生合成遺伝子等の発現が上がる。すなわち、DELLAは、下流遺伝子の転写を抑制する一方で、促進もする。最近、Tai-ping Sunらのグループは、DELLAタンパク質が様々な転写因子と複合体を作って転写を正にも負にも制御しているという論文を発表している14)。彼女らの視点で重要な点は、DELLAタンパク質が転写因子と同時にヒストンタンパク質とも結合し、転写制御をしているというものである。今後は、このような新しい視点からの研究も加わり、ジベレリンシグナル伝達の全体像が浮かび上がってくるものと信じている。 6.最後にここ20年余りの間、英米諸国と日本は、前者はシロイヌナズナ、後者はイネを主に利用して、ジベレリンシグナル伝達研究のデッドヒートを繰り広げてきた。それは、植物分子遺伝学の興隆や、国際協力の下で行われたゲノムプロジェクトとも無縁ではなかったであろう。また、タンパク質の構造解析も重要な知見を与えてくれた。今後は、受容体・生合成・代謝酵素等の立体構造に基づいたアゴニスト・アンタゴニストの創生などを利用した草丈・開花・発芽調節なども可能となるかもしれない。 文献)
略歴
上口(田中)美弥子 1980年3月京都大学農学部農芸化学科卒業、1982年3月京都大学大学院農学研究科博士前期課程修了、1986年3月京都大学大学院農学研究科博士後期課程満期退学、1986年4月大阪府立公衆衛生研究所研究員、1996年名古屋大学研究員、2008年名古屋大学生物機能開発利用研究センター准教授、2020年名古屋大学生物機能開発利用研究センター教授、2023年3月同センター退職、2023年4月同センター客員研究員。植物ホルモンであるジベレリンの合成や代謝酵素およびシグナル伝達因子の構造を明らかにすることにより,植物の伸長や生殖といった植物の基本的有り様を理解したいと考えている。
サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |


