|
アポカロテノイドの同定と細胞機能調節作用に関する研究
北海道大学大学院水産科学研究院
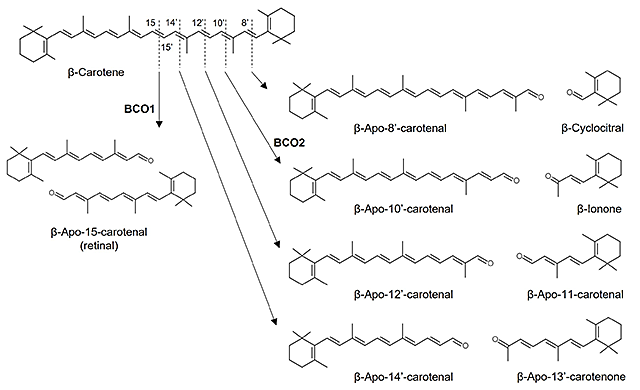
助教 高谷 直己 1.はじめにカロテノイドはイソプレノイド骨格を有し赤~黄色を呈する脂溶性色素であり、植物や海藻、一部の微生物において生合成される。ヒトを含む動物はカロテノイドを生合成することができないが、日々の食事から摂取されるため、血中をはじめとした生体組織において検出される。カロテノイドの健康機能性に関する研究の進展により、プロビタミンA活性や抗酸化作用に加えて、免疫制御機能や生活習慣病予防効果などの新たな生理作用が見いだされている。そのような生理作用の機能発現には、生体内での代謝動態が関与すると推測されるが、カロテノイド代謝物の分布や代謝物による生物活性まで明らかにされたものは一部に限られる。ところで、哺乳類において2種のカロテノイド開裂酵素β-carotene-15,15’-oxygenase(BCO1)およびβ-carotene-9’,10’-oxygenase(BCO2)が同定されている。BCO1はポリエン鎖中央部(C-15, 15’位)での酸化開裂反応を触媒する酵素で、β-カロテンからretinal(β-apo-15-carotenal)を生成する1)。一方、BCO2はBCO1と比べて、より多種のカロテノイドを基質とすることができ、ポリエン鎖上C-9’, 10’位での非対称な開裂反応を触媒する。例えば、β-カロテンを基質とした場合、β-apo-10’-carotenalおよびβ-iononeを生成する2)。これらに加えて、非酵素的な酸化開裂反応によってもカロテノイド開裂物(アポカロテノイド)が生じる(図1)。また、近年の分析技術の発展により、血中をはじめとした生体組織から多様なアポカロテノイドが見いだされている3,4)。これらの事実は、摂取されたカロテノイドの生理作用発現と生体内に存在するアポカロテノイドとの関連を予想させる。我々は、カロテノイドの健康機能性メカニズムの解明を目指して、アポカロテノイドの生体内における同定をはじめとして、調製法の検討や生物活性の評価を行っている。本稿では、我々が最近得た知見を中心に、これまでに明らかにされたアポカロテノイドの細胞機能調節作用について一部紹介したい。 図1.カロテノイドの酸化開裂によるアポカロテノイドの生成 ポリエン鎖上の任意の位置における酵素的あるいは非酵素的な酸化開裂反応によって多様なアポカロテノイドが生じる。
2.β-カロテンおよびリコペン由来アポカロテノイドの生物活性カロテン類(炭素原子と水素原子のみから構成されるカロテノイド)に分類されるβ-カロテンやリコペンは、自然界に最も豊富に存在するカロテノイドのひとつで、野菜や果物、海藻など多くの食物中に含まれる。上述のように、BCO1やBCO2による酵素反応および非酵素的な酸化開裂反応を介して、これらカロテノイドから様々なアポカロテノイドが生じる。いくつかのβ-カロテン由来非対称アポカロテノイドは、核内受容体のアンタゴニストとして働くことが報告されている5)。特に、β-apo-13-carotenone はall-trans-レチノイン酸によるレチノイン酸レセプター(retinoic acid receptors; RARs)のトランス活性化を強く阻害するが、この機序として、受容体への結合に対するレチノイン酸との競合や、レチノイドXレセプター(retinoid X receptors; RXRs)のオリゴマー状態の調節6)を介すると考えられている。また、β-apo-13-carotenone がヒト血中に認められる濃度と近しい濃度で活性を示すことは、当該分子の生理的意義を想起させるもので興味深い5)。さらに、β-apo-14’-carotenalは、アゴニストによって誘導されるRXRα、ペルオキシソーム増殖剤活性化受容体(peroxisome proliferator-activated receptor; PPAR)αおよびPPARγの活性化を阻害し、マウス前駆脂肪細胞3T3-L1の分化に関わる遺伝子発現を減少させることが報告された7)。 リコペン由来アポカロテノイドであるapo-6’-, -8’-, -10’-, -12’-, -14’-lycopenalが、トマトジュースを摂取したヒト血中に認められている8)。Apo-12’-lycopenalはPPARγを活性化して3T3-L1前駆脂肪細胞の分化を促進することが示されている9)。また、ヒト気道上皮細胞BEAS-2Bにおいて、apo-10’-lycopenoic acidが、細胞内抗酸化機構であるNrf2(nuclear factor E2-related factor 2)の核内蓄積を介してheme oxygenase-1をはじめとする抗酸化酵素群のmRNA発現増加を誘導し、活性酸素種の蓄積や過酸化水素による細胞障害が緩和される10)。さらに、生活習慣病に対する効果として、肥満モデルob/obマウスへのapo-10’-lycopenoic acidの投与が、肝臓におけるsirtuin 1の遺伝子発現および活性を増加させ、脂肪肝の進行を抑制することが報告されている11)。 以上のように、カロテン類であるβ-カロテンやリコペン由来アポカロテノイドに関する研究は進められているものの、キサントフィル類(分子内に酸素原子を含むカロテノイド)由来アポカロテノイドに関するものは極めて少ない。我々は最近、海産生物に含まれる海洋性キサントフィル類に由来するアポカロテノイドについて、マウス生体内での存在や生物活性に関していくつかの知見を得たので、次にその内容を紹介する。
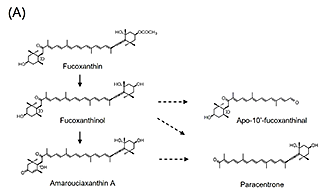
3.フコキサンチン由来アポカロテノイドの同定と抗炎症活性フコキサンチンはワカメなどの褐藻類や珪藻類に含まれる橙色の海洋性カロテノイドで,血糖改善作用12)や抗肥満作用13)、非アルコール性脂肪肝炎(Non-alcoholic steatohepatitis; NASH)発症予防効果14)を示す。摂取されたフコキサンチンは腸管にてフコキサンチノールに加水分解されて吸収された後、その一部は肝臓においてアマロウシアキサンチンAに変換される15)。我々は、フコキサンチンを摂取させたマウスの体内から、フコキサンチノールおよびアマロウシアキサンチンAに加えて、フコキサンチン由来アポカロテノイドであるパラセントロンおよびapo-10’-fucoxanthinalを見いだした(図2(A))。これまでフコキサンチン由来アポカロテノイドの生体内での存在は不明であったが、フコキサンチンを摂取させたマウスの肝臓や脂肪組織、腎臓、筋肉、血液など生体組織に広く蓄積することが明らかとなった16)。 近年、糖尿病や肥満、NASHをはじめとした慢性炎症疾患の発症基盤として、生体組織中のマクロファージによる過剰な炎症応答が潜在することが明らかとなりつつある。そこで我々は、パラセントロンを含むフコキサンチン由来アポカロテノイドの、マクロファージに対する炎症制御機能を評価した。マウスマクロファージ様RAW264.7細胞は、リポポリサッカライド(lipopolysaccharides; LPS)による刺激に応じて炎症性因子を過剰産生するが、パラセントロンおよびapo-10’-fucoxanthinalを予め処置しておくことで、炎症性サイトカインであるインターロイキン-6(Interleukin-6; Il6)や炎症性メディエーターである一酸化窒素合成酵素(Nitric oxide synthase 2; Nos2)のmRNA発現上昇が下方制御されることが分かった(図2(B))16)。興味深いことに、その活性は完全鎖長を持つフコキサンチノールよりも強かった。上述のように、フコキサンチンは肥満やNASHといった慢性炎症疾患に対して抑制的に働くことから、その作用の一部にフコキサンチン由来アポカロテノイドによる炎症制御機能が関与する可能性が考えられる。 図2.フコキサンチン由来アポカロテノイドの同定と抗炎症活性(文献16より改変)
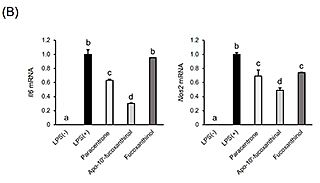
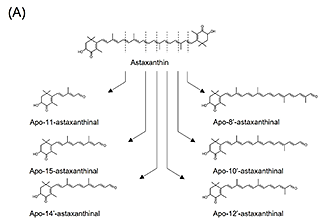
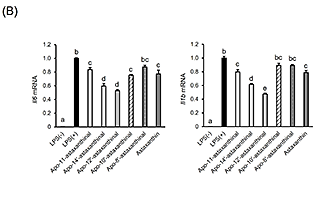
4.アスタキサンチン由来アポカロテノイドの調製と抗炎症活性アスタキサンチンは、エビなどの甲殻類、微細藻類など広く海洋生物に含まれる赤色の海洋性カロテノイドで、強力な抗酸化作用をはじめとした多様な生理作用が明らかとなっている。最近、BCO2欠損マウスにアスタキサンチンを投与したところ、アスタキサンチン蓄積量の増加が観察された17)。また、アスタキサンチンを処置したラット肝細胞中から、いくつかのアスタキサンチン由来アポカロテノイドが同定された18)。これらの結果は、アスタキサンチンが生体内にて代謝開裂を受けることを示唆するものであり、アスタキサンチンによる生理作用の一部にアポカロテノイドが関わる可能性を予想させる。しかしながら、アスタキサンチン由来アポカロテノイドの生物活性はこれまで調べられていなかった。そこで我々は、過マンガン酸カリウムを用いた酸化反応により、アスタキサンチンから種々の炭素鎖長を持つアポカロテノイドを調製し(図3(A))、RAW264.7細胞に対する炎症制御機能を評価した。図3(B)に示すように、アスタキサンチン由来アポカロテノイドを予め処置しておくことで、LPSによって誘導される炎症性サイトカインIl6およびIl1bのmRNA発現上昇が下方制御されることが分かった19)。この作用は鎖長依存的で、中央部位に近い位置で開裂したapo-12’-astaxanthinalやapo-14’-astaxanthinalは特に強い炎症制御機能を示した。また、完全鎖長を持つアスタキサンチンと比較して高い活性を示すことから、開裂により抗炎症作用が増強するものと推測される。しかしながら、今回調製したアスタキサンチン由来アポカロテノイドが生体内で見いだされた例はなく、今後これらを標品として用いることで組織分布や代謝動態を精査する必要がある。 図3.アスタキサンチン由来アポカロテノイドの調製と抗炎症活性(文献19より改変) (A)アスタキサンチンの酸化反応により生じるアポカロテノイドの分子構造。 (B)RAW264.7細胞にカロテノイドを処置(5 μM)後、LPSにて炎症誘導した際の炎症関連因子mRNA相対発現レベル。値は平均±標準誤差(n=3)。異文字間で有意差あり(p<0.05)。
5.おわりに本稿では、β-カロテンおよびリコペンに加えて、海洋性カロテノイドのフコキサンチンおよびアスタキサンチン由来のアポカロテノイドの同定や抗炎症活性に関する知見について紹介した。加えて、現在我々は、β-カロテンの末端環状構造が開裂したアポカロテノイド20)や、ルテインやカプソルビンなど他のキサントフィル類からのアポカロテノイド調製法の確立や生物活性の評価を進めている。それらアポカロテノイドを分析標品として使用することは、これまで見過ごされていた生体中アポカロテノイドの同定をはじめとして、カロテノイド含有食品中に含まれるアポカロテノイドの定量や、食事を介したアポカロテノイドの生体吸収および代謝動態の解析など多岐にわたる研究の推進に役立つと思われる。さらに、様々な分子構造を有するアポカロテノイドを用いたケミカルバイオロジー的検討により、活性分子構造の推定や生理活性物質の創出、カロテノイド代謝物の新たな生物活性の解明に繋がる可能性がある。今後は、アポカロテノイドの生体組織分布や、代謝酵素の発現挙動を踏まえた体内動態、そして生理機能との関連についての研究を通して、カロテノイドによる健康作用メカニズムの解明、そしてその理解を基盤とした機能性食品や医薬品開発などの新技術への展開が期待される。
謝辞本研究の一部は、日本学術振興会科学研究費助成事業の助成(18H02274, 19J11147, 21K20589, 23K14018)によって執り行われました。また、研究の進展に多大なご協力を賜りました神戸薬科大学・山野由美子先生、一般財団法人生産開発科学研究所・眞岡孝至先生に御礼申し上げます。 文献
略歴
高谷 直己 北海道大学大学院水産科学研究院 助教
【略歴】 2015年北海道大学大学院水産科学院修士課程修了後、フジッコ株式会社にて研究員として勤務。 2019年日本学術振興会特別研究員(DC2)採用、2021年北海道大学大学院水産科学院博士後期課程修了を経て、2021年4月より現職。 この間、日本油化学会関東支部若手研究者奨励賞(2020)を受賞。 サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |