|
サメ抗体の不思議と今後の研究展望
東京海洋大学 海洋生物資源学部門
教授 近藤 秀裕 1. はじめにサメやエイといった軟骨魚類は、日本では食用としてフカヒレやエイヒレの他、はんぺんの原料として用いられる。また、地方によってはフカの湯ざらしなどの調理法で食されることもある。著者が山陰地方で聞いた話では、サバなど傷みやすい魚は塩蔵や加熱処理をしないと遠くに運ぶことができなかったが、サメはアンモニアを含むため腐敗しにくかったことから、海から離れた地域において生魚として重宝されていたとのことである。一方で軟骨魚類は、1998年に発見された新たな抗体分子に注目が集まり、近年様々な研究がなされている。本報では、この新規抗体を含む軟骨魚類の抗体の特徴について概説する。 2. 抗体分子について抗体は脊椎動物における生体防御に重要な分子である。COVID-19の世界的なパンデミックに伴い、ワクチン接種により誘導される抗体が着目されていることから、本分子についての説明は不要かとも考えられるが、今一度、簡単に説明をさせていただく。抗体分子は重鎖と軽鎖からなる4量体を一つのユニットとし、このユニットが一つあるいは複数組み合わさったタンパク質である(図1A)。抗体分子は、1)重鎖と軽鎖の多様性決定領域のアミノ酸配列をコードする遺伝子が遺伝子組換えにより変化すること、2)多様性決定領域遺伝子上で塩基置換を受けること、3)重鎖と軽鎖が組み合わさって一つの分子を構成すること、の3つにより可変領域に多様性が生じ、様々な分子を認識できるようになる。哺乳類の場合、1)により出現する遺伝子配列パターンは百万通りを越え、最終的に1011通り以上の抗体分子が出現すると考えられる。生体内に異物が侵入すると、異物に特異的に結合する抗体を産生する細胞が選択され、増殖することで特異的な抗体の産生量が増加する。
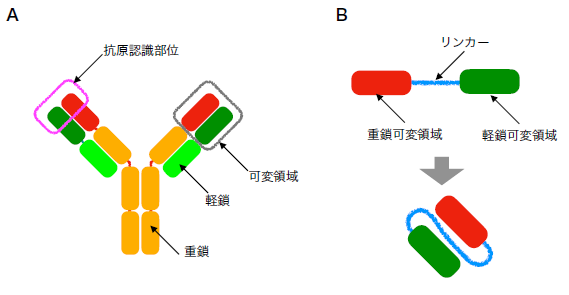 図1.一般的な抗体(A)および人工一本鎖抗体(B)の構造模式図 抗体は様々な分子を認識しうる性質を持つことから、医療分野のみならず、食品分野においてアレルゲンや食中毒菌・毒素の検出などにも利用されている。このような抗体は、ウサギやラットといった動物を免疫して得られるポリクローナル抗体と、免疫した動物の抗体産生細胞を不死化細胞と融合させて得られるハイブリドーマを培養することで得られるモノクローナル抗体に分けられる。とくにモノクローナル抗体は、単一の抗原を認識する可変領域をもつ抗体のみからなるため特異性が高い。これまでに様々な分子を認識するモノクローナル抗体が作られてきており、このような抗体を用いて、目的とする抗原分子を検出するためのEnzyme-linked immune sorbent assay(ELISA)やイムノクロマトアッセイなどが開発されている。 しかしながら、モノクローナル抗体の調製には労力とコストがかかる。さらに、動物を免疫しても特異的な抗体が得られないような分子に対しては、抗体の調製が困難となることもある。このような背景から、遺伝子工学的な手法を用いて抗原特異的な遺伝子断片を単離し、人工抗体組換えタンパク質を調製する試みがなされている。先にも述べたように、抗体は重鎖と軽鎖からなる可変領域が抗原となる分子と特異的に結合する。これらの鎖はそれぞれ異なる遺伝子によりコードされており、人工抗体を作出する際には、これらの二本の鎖をコードする遺伝子断片間にリンカーとなるアミノ酸配列を挿入することで、人工的に一本鎖化した遺伝子断片を調製する必要がある(図1B)。このような人工一本鎖抗体は、必ずしも目的の構造を取らないことがあり、リンカーの長さやアミノ酸配列を変えるなどの工夫がなされている。しかしながら、本手法で得られる抗体遺伝子は、人工的に組み合わせや配列を改変できるため、動物を用いた場合には得ることが難しいような抗体を作出できる可能性も秘めている。このように得られた抗体遺伝子のレパートリーの中から、抗原特異的な人工抗体遺伝子を単離するための手法として、ファージディスプレイ法、リボゾームディスプレイ法、バクテリアディスプレイ法など、様々な手法が開発されている。その中でもファージディスプレイ法は、広く抗原特異的な抗体遺伝子の単離に用いられている1)。 3. 重鎖のみからなる一本鎖抗体人工一本鎖抗体を用いた遺伝子工学的な特異抗体作出は、様々なメリットが考えられる。しかしながら、重鎖遺伝子と軽鎖遺伝子を組み合わせる過程で抗原特異的な組み合わせをとらない可能性や、重鎖遺伝子と軽鎖遺伝子それぞれが多様性を持つことからPCRによる遺伝子増幅に必要なプライマーセットが膨大になってしまうなどの問題点がある。一方、アルパカやラマなどラクダ科の動物は、他の哺乳類には見られない重鎖のみからなる一本鎖抗体を持つことが報告されている2)。本抗体は重鎖のみで抗原と結合することから、ファージディスプレイ法のような遺伝子工学的手法を用いた特異抗体遺伝子の探索が容易であること、重鎖部分の分子サイズが約15kDaと重鎖と軽鎖からなる一本鎖抗体に比べて小さく人工的に大腸菌などを用いて発現させることが容易であること、などの利点があることから、応用に向けた研究が進められている。 興味深いことに、重鎖のみからなる一本鎖抗体は軟骨魚類からも見つかっている。この抗体は新規免疫グロブリン様分子(novel antigen receptor: IgNAR)と呼ばれ、ラクダ科のものとは構造的に異なる種類のものである3)。重鎖のみで抗原を認識する一本鎖抗体は、軟骨魚類とラクダ科以外の脊椎動物からは見つかっていない。軟骨魚類のIgNARも、重鎖と軽鎖からなる一般的な抗体と同様に、遺伝子組換えによる遺伝子配列の多様性がみられ、免疫により抗原となる分子に特異的に結合する。 4. 抗体遺伝子の進化そもそも何故、食用以外に利用されることのない軟骨魚類において、抗体の研究が進められていたのかというと、軟骨魚類は抗体を中心とした脊椎動物の獲得免疫に関わる遺伝子群を最初に獲得した生物だからである。脊椎動物の祖先は、ヤツメウナギやメクラウナギのような顎を持たない生物(無顎類)であると考えられる。ヤツメウナギの仲間は、抗体遺伝子を持たないものの、抗体と同じように異物を凝集する分子を血中に持つことが知られており、後に凝集原として可変性リンパ球受容体(VLR)と呼ばれる遺伝子が同定されている4)。一方、現生の脊椎動物の祖先が無顎類から分岐した後、最初に出現した生物はエイやサメを含む軟骨魚類であると考えられるが、軟骨魚類は、免疫グロブリン遺伝子や、その遺伝子組換えに関わるrecombination activating geneなどを有している5)。 軟骨魚類は、免疫グロブリンM(IgM)、W(IgW)、およびIgNAR遺伝子を持つ。軟骨魚類のIgMは重鎖と軽鎖のユニットが4つあるいは1つからなる四量体または単量体のタンパク質である6)。硬骨魚類のIgMは四量体であり、哺乳類のものは五量体である。軟骨魚類では、血中IgMは全血清タンパク質の50%以上を占める主要な血清タンパク質であり、抗原認識による生体防御以外にも、哺乳類血中におけるアルブミンのように膠質浸透圧調整や低分子物質の運搬などの役割を持つのではないかと考えられている。 コモリザメを対象とした研究では、IgMはIgNARと同様、免疫により抗原に対する特異性が上昇するが、免疫後、特異抗体が検出されるまでに数ヶ月を要することが示されている。一方、我々は日本近海に生息するドチザメを対象にニワトリ卵白リゾチームや種々の魚病細菌を用いた免疫を試みてきたが、抗原特異的な抗体価の上昇は観察されていない(未公開データ)。哺乳類では、免疫後数週間で抗原特異的なIgMが出現し、その後、クラススイッチと呼ばれる重鎖遺伝子の変化により抗原特異的なIgGが観察されるようになる。一方で軟骨魚類の抗原に対する特異抗体の応答は、哺乳類のものに比べると時間がかかるか、あるいは応答が全く見られない場合があることから、軟骨魚類の抗体は哺乳類のものに比べて獲得免疫系の生体防御において重要性が低いのかも知れない。 また、ドチザメは他の軟骨魚類と同様、血中IgM濃度が高い。図2にドチザメ血清のゲルろ過溶出パターンおよびSDS-PAGEパターンを示したが、4量体および単量体の抗体が高濃度に存在している(図2)7)。
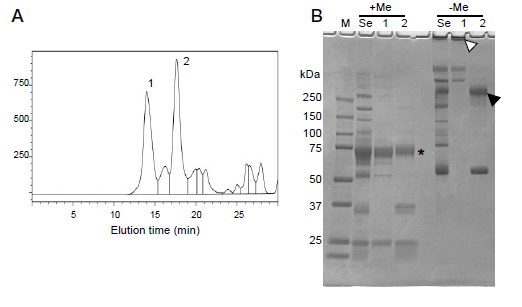 図2.ドチザメ血清のHPLC溶出曲線(A)およびSDS-PAGE電気泳動像(B) (A)中のピーク1および2は、(B)中のレーン1および2に対応する.
さらに解析を進めたところ、天然から採捕した健常な個体由来の血清抗体は種々の魚類病原細菌に結合することが明らかとなった(図3)。 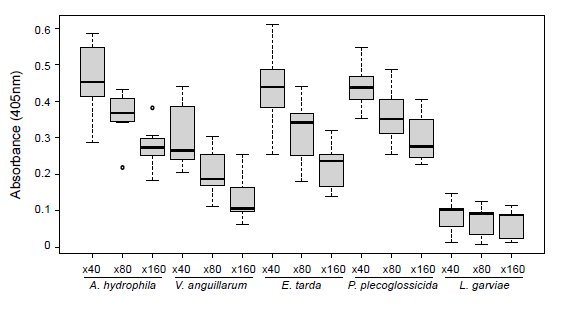 図3.各病原細菌へのドチザメ血清抗体の結合 魚病細菌のAeromonas hydrophila、Vibrio anguillarum、Edwardsiella tarda、Pseudomonas plecoglossicida、およびLactococcus garvieaeに対するドチザメ抗体の結合について抗ドチザメIgM抗体を用いたELISAで解析した.下段倍率は血清の希釈倍率.
免疫を受けた経歴や感染症の罹患履歴のない動物が種々の病原細菌に対して特異的な抗体を持つという性質は、軟骨魚類に近い硬骨魚類であるチョウザメのIgMにおいても見られる8)。軟骨魚類やチョウザメがこのように多様な抗原に対して特異的に結合する抗体を常に持つことは、これらの魚種の抗体が自然免疫系の生体防御において重要な機能を果たしている可能性を示唆するものである。 5. 軟骨魚類抗体の応用軟骨魚類がもつIgNARは、ラクダ科のもつ一本鎖抗体とは系統的に全く異なる分子である。しかしながら、ラクダ科のものと同様、分子サイズが小さく熱安定性に優れていることから、遺伝子工学的手法を用いた人工抗体の材料として注目されている。とくに、IgNARの抗原認識配列領域には3箇所の相補性決定領域(CDR)が存在するが、このうち3番目のCDR3が抗原認識に重要であることから、この領域に人工的なランダム配列を組み込むことにより抗原認識配列の多様度を高めることが可能である9)。そこで、CDR3にランダム配列を組み込んだ人工遺伝子ライブラリーを作出し、ファージディスプレイ法を応用することで、様々な抗原に結合する抗体の単離が試みられており、我々も本手法を利用して魚病ウイルスに特異的に結合するドチザメIgNAR遺伝子を単離した10)。本手法は、抗体を調製する上で飼育が困難で免疫に時間がかかるという軟骨魚類の弱点を克服するものであり、さらに自然界には存在しない抗体遺伝子パターンを作出することが可能となる。このような技術を応用することで、哺乳類の生体分子に対するIgNAR抗体や、様々な病原微生物に対するIgNARも作出されてきている。また、IgNARは重鎖のみからなることを利用し、抗原特異的な配列に人為的な塩基置換を加え、人工的に多様性を持たせることで、抗原-抗体間の親和性を高めたクローンを単離する試みもなされている。 6. おわりに本報では、軟骨魚類がもつ抗体について、その特徴と応用に向けた研究成果について紹介した。ここで紹介した通り軟骨魚類は、脊椎動物が獲得免疫に関わる遺伝子群をどのように獲得したのか、という進化生物学的な研究対象から、IgNARという独特な抗体の発見を通して、その応用が進められている。このような抗体は、分子の検出の他、抗体医療への応用も期待されており、今後、身近なものに軟骨魚類の抗体が利用される日が来るのかも知れない。 引用文献
略歴
近藤 秀裕 1997年3月東京大学農学部水産学科卒業、1999年3月東京大学農学生命科学研究科博士前期課程修了、2003年3月東京大学農学生命科学研究科博士後期課程修了、2003年4月日本学術振興会特別研究員PD、2005年4月東京海洋大学科学技術研究科助手、2009年11月東京海洋大学科学技術研究科准教授、2016年4月東京海洋大学海洋生物資源学部門教授。魚介類の免疫機構について分子生物学的アプローチで研究を進めている。
サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |


