|
フグの毒化関連タンパク質
新潟食料農業大学 食料産業学部
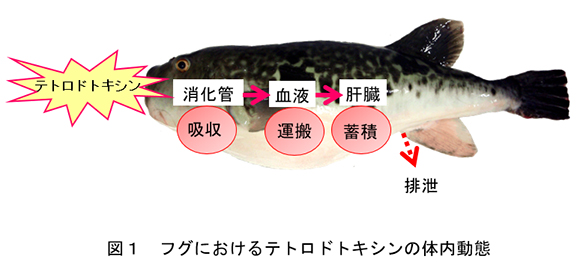
教授 長島 裕二 1.はじめにフグは強力な神経麻痺毒テトロドトキシン(TTX)をもち、主な毒化経路は海洋微生物によって産生されたTTXを出発点とする食物連鎖説が有力視されている。これは、TTXとの接触を断った条件下で人工飼育されたクサフグやトラフグは毒性を示さないこと、そして、人工飼育された“無毒”のクサフグやトラフグにTTXを含む餌料を投与するとフグは毒化されてTTXを肝臓などに蓄積することが根拠になっている1)。給餌飼育によるフグ毒化実験の結果は、経口摂取されたTTXは腸管で吸収され、血液による運搬を経て、肝臓など特定の組織に取り込まれて濃縮、蓄積するという一連の体内動態が成立していることを示している(図1)。フグ毒化メカニズムにはいまなお不明な点が残されているが、毒化に関わるタンパク質が明らかになってきたので、そのいくつかを紹介する。
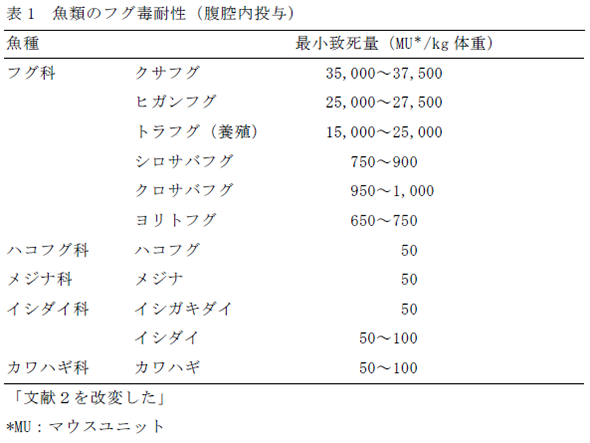
 2.フグ骨格筋のナトリウムチャネルフグが高濃度のTTXを体内に保持蓄積できる要因の一つに、TTXに対する強い耐性をもつことが挙げられる。表1にTTX溶液を各種魚類に腹腔内投与したときの最小致死量を示す2)。有毒種フグのクサフグ、ヒガンフグ、トラフグの最小致死量は15,000~37,500マウスユニット(MU)/kg体重(マウスユニット(MU)は毒の強さを表す単位で、1MUはTTX 0.22 µgに相当する)で、TTXをもたない一般魚の50~100 MU/kg体重に比べ数百倍高い。無毒種のシロサバフグ、クロサバフグ、ヨリトフグは650~1,000 MU/kg体重で、一般魚と有毒種フグの中間的な値を示した。フグは他の魚種に比べて格段に強い耐性を示すが、多量のTTXを強制投与されるとフグといえども麻痺を起こして死亡する。 このフグのTTX耐性にナトリウムチャネルが関係している。ナトリウムチャネルはTTXを特異的に結合し、可逆的に結合と解離を行うTTX結合タンパク質だが、TTXに対する感受性が高いものと低いものがある3)。タンパク質一次構造から、骨格筋や脳のナトリウムチャネルはTTX感受性型、心筋のそれは耐性型に分類できるが、ヒガンフグ骨格筋のナトリウムチャネルのサブタイプの一つ(fMNa1)はTTX耐性型であることが示唆されている4)。
 3.フグ血漿のフグ毒結合タンパク質PSTBPMatsuiらはクサフグ血漿からTTXを結合する分子量116kのタンパク質を精製し、N末端部分アミノ酸配列を決定した5)。その後、Yotsu-Yamashitaらは、トリチウムラベル化された麻痺性貝毒サキシトキシン(STX)[3H]STXに対する結合性を指標にして、ヒガンフグ血漿から分子量200kの[3H]STX結合タンパク質を単離した6)。本タンパク質の[3H]STX結合はTTX添加で阻害されたことから、[3H]STX結合タンパク質はpufferfish saxitoxin and tetrodotoxin binding protein (PSTBP)と命名された。しかし、PSTBPと[3H]STXの結合を50%阻害するSTXとTTXの濃度(IC50)を比較すると、TTXはSTXの約1000倍高く、PSTBPの毒素との結合は圧倒的にSTXに優位であった。 PSTBPはフグの体内でどのような働きをしているのだろうか。Yotsu-YamashitaらはPSTBP抗体を用いたWestern blot分析でPSTBPの組織間分布を調べたところ、ヒガンフグの皮膚、筋肉、肝臓、心臓、腎臓、脾臓、胆のう、腸、生殖腺、鰓でPSTBPが検出され、中でも皮膚のバンドが最も強く、PSTBPは皮膚に多く存在することがわかった7)。また、魚種間の分布については、ヒガンフグ以外にフグ科のクサフグ、コモンフグ、ショウサイフグ、トラフグ、ナシフグ、マフグの血漿でPSTBPは検出されたが、一般魚のアイナメ、クロソイ、ババガレイ、ヒラメではPSTBPは検出されなかった。 すなわち、PSTBPは一般魚には存在せずフグ科に共通して分布し、フグでは血漿以外にも広く各組織に分布していることから、PSTBPはTTXの輸送と体内分布に関与していることが示唆された。 TTXはPSTBP以外にも血液中のアルブミンやα1-酸性糖タンパク質(AGP)と非特異的に結合する8)。筆者らは、トラフグ活魚から採血して血漿を調製し、これにTTX(100 µg/mL)を添加して平衡透析法で血漿タンパク質のTTX結合を調べた。対照としてTTXをもたないアイナメを用いて同様の実験を行った。その結果、トラフグ血漿ではタンパク質1mgあたり0.47±0.16 µgのTTXが結合し、アイナメでも0.35±0.05 µg TTXが結合し、魚類血液中ではTTXは血漿タンパク質と非特異的な結合が起こっていることがわかった。そこで、ウシ血清アルブミン(BSA)とウシAGP溶液を調製してTTX結合力を調べたところ、BSAでは0.82±0.13 µg TTX/mg BSA、AGPは3.53±0.25 µg TTX/mg AGPとなり、TTXとは無縁のウシ由来のBSAやAGPがトラフグ血漿を上回るTTX結合力を示したのは意外であった。 アルブミンやAGPは動物血漿中の主要なタンパク質で、薬物の輸送のみならず血中貯蔵にも大きな役割を果たしている。したがって、これら血漿タンパク質による非特異的な結合もTTX輸送の一端を担っていると推測される。 4.フグ卵巣のフグ毒結合タンパク質ビテロジェニンフグ卵巣には高濃度のTTXが蓄積しており、これは卵からふ化したフグ稚魚を守るための生体防御に関与しているという興味深い報告がある9)。また、卵巣のTTXは雌の性成熟に伴って卵巣が成熟する際、肝臓から移行する10)と考えられているが、どのように移行するのだろうか。 筆者らは、有毒ヒガンフグの卵巣から、フグ毒関連物質との結合を指標にしてフグ毒結合タンパク質を精製した11)。その結果、分子量10kと15kの二つのフグ毒結合タンパク質(Takifugu pardalis ovary toxin-binding protein、TPOBP)を得た。このうち分子量10kのフグ毒結合タンパク質(TPOBP-10)は卵黄タンパク質ビテロジェニンのvon Willebrand factor (vWF)type Dドメインの部分断片であることを明らかにした。 ビテロジェニンは肝臓で合成され、血液を介して卵巣に移行し、卵内でリポビテリン(重鎖と軽鎖)、ホルビチン、vWF type Dドメインに分離する。そして、魚類ではvWF type Dドメインはβ-コンポーネントとC-末端領域に分けられることもある。TTXもビテロジェニンも肝臓から卵巣に移行するが、両者は肝臓で結合して結合体として卵巣に移行するのか?あるいは、TTXとビテロジェニンは別々に卵巣に移行し、卵内でビテロジェニンから分離したvWF type DドメインとTTXが結合するのだろうか? 筆者らはヒガンフグ卵巣からフグ毒を結合した状態のタンパク質を単離したが、最近、QiaoらはコモンフグからvWF type Dドメインのリコンビナントタンパク質を合成し、これがTTXと可逆的に結合することを確認し、TTXの輸送に関与していると示唆した12)。vWF type Dドメインがフグの毒化に関連することは間違いないが、肝臓から卵巣へTTXを運ぶ輸送タンパク質なのか? 卵巣でTTXを保持蓄積する貯蔵タンパク質なのか? vWF type DドメインはTTXだけを選択的に結合するのか? vWF type DドメインのTTX結合はフグに特有なのか?まだまだ解決すべき課題が残されている。 5.最後に本稿では、フグの毒化に関連するタンパク質として、骨格筋神経、血漿および卵巣で機能するタンパク質を紹介した。筆者らが行ってきたトラフグにおけるTTXの体内動態解析で、肝臓がフグ毒化の主要な支配要因であることが確認され、他魚種との決定的な違いが肝臓でのTTXの取り込みにあり、肝臓へのTTX取り込みにトランスポーターが関与していること、また、有毒フグ肝臓にフグ毒結合タンパク質成分の存在が示唆されており、毒化のいろいろな場面でさまざまなタンパク質が活躍しているものと推測される。今後、これらフグ毒関連タンパク質が明らかになり、フグ毒化の全貌が解明されることを期待したい。 引用文献
略歴長島 裕二 新潟食料農業大学・食料産業学部・教授
1980年3月東京水産大学食品生産化学科卒業、1982年3月東京水産大学大学院食品生産化学専攻修士課程修了、1984年11月東京大学大学院農学系研究科水産学専門課程博士課程中途退学、1984年12月東京水産大学食品工学科助手、1992年6月東京水産大学食品生産学科助教授、2004年4月東京海洋大学海洋食品学科教授、2018年4月新潟食料農業大学教授。フグ毒を中心とした魚介類の毒と魚類の有用生理活性物質を主な研究テーマとしている。 サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |

