|
AGEsからみるアンチエイジング戦略
東海大学農学部 食生命科学科
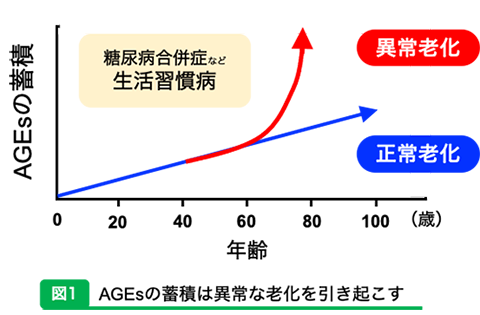
東海大学大学院 農学研究科 東海大学大学院 生物科学研究科 教授 永井 竜児 東海大学大学院 生物科学研究科 博士課程 山口 広子 アンチエイジングと聞くとみなさんはどのようなことを思い浮かべるだろうか?美容の世界において頻繁に耳にする言葉だが、私たちの健康にも密接に関係していることも認知されるようになってきている。本稿ではエイジング、つまり老化の原因のひとつである糖化とその終末糖化産物であるAGEsからみたアンチエイジングについて、食品成分との関わりやその分析手法について紹介する。 はじめに(メイラード反応と糖化反応)メイラード反応は1912年にフランスの化学者であるメイラード博士によって発見されたアミノカルボニル反応であり1)、糖とタンパク質が結合することによってメラノイジンを生成する。このメラノイジンは、日本では古くから食品の風味付けや色付けなどに利用されてきた。私たちの身近では、味噌や醤油、ビールやワイン、コーヒーなどにメラノイジンが含まれており、食のおいしさに一役買っていると言える。 いいことばかりかと思われるメイラード反応だが、身体で起こると途端に弊害が生じてしまう。生体内でのメイラード反応は糖化と呼ばれることが多く、食事で摂取した過剰な糖と生体内のタンパク質が結合することで最終的にAGEs (エージーイー・Advanced glycation end products:終末糖化産物)を生成する。AGEsは通常、加齢に伴ってゆるやかに蓄積するが2,3)、生活習慣病などにおいては加速的に蓄積が増加する4)。そのため、AGEsは加齢関連疾患の指標になると考えられている(図1)。
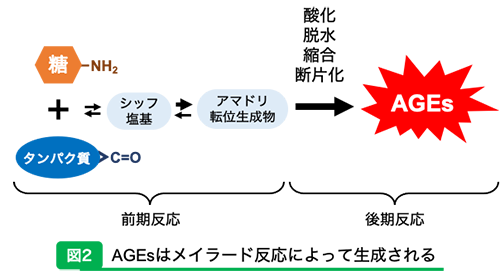
さまざまなAGEs の生成経路生体内でAGEsはグルコースなどの還元糖のカルボニル基とタンパク質中のリジンやアルギニンなどの側鎖アミノ基が非酵素的に結合し、シッフ塩基やアマドリ転位生成物を生成する前期反応、それに続いて酸化・脱水・縮合・断片化などの後期反応が起こることで不可逆的に生成する(図2)。
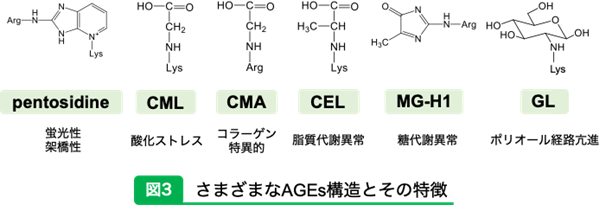
ひとえにAGEsと言ってもさまざまな構造や特徴が存在している。蛍光性のAGEsに代表されるものとしてはペントシジンがある5)。非蛍光性のAGEsには酸化ストレスの存在下で生成されやすいCML(カルボキシメチルリジン)や6)、コラーゲンに特異的に生成されるCMA(カルボキシメチルアルギニン)7)、ケトン体の代謝によって生成されるCEL(カルボキシエチルリジン)8)、さらには糖代謝異常で生成されやすいMG-H1(メチルグリオキサールハイドロイミダゾロン1)9)やポリオール経路の亢進によって生成するGL(グルコースリジン)10)などがある(図3)。さらに最近の研究で、糖とタンパク質からのみ生成されると考えられていたAGEsに、酸化した脂質やビタミンCからも生成される新しい経路が報告されている11)。 このようにさまざまなAGEsが複数の経路から生成されるため、ターゲットにするAGEsを測定することで生体がどのような代謝状態であるかを知る手がかりにすることが可能になると考えられる。
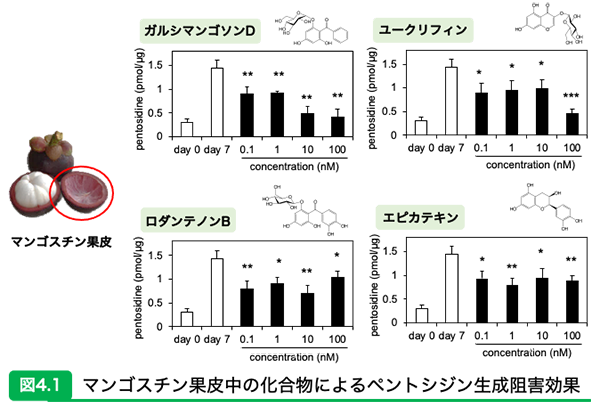
我々は、AGEs阻害効果のある食品成分の探求、主要AGEs構造の同定や病態との関連性の評価、さらには多検体分析に向けたAGEs測定手法の確立を行なっている。そのなかでも我々が行なっているAGEsの分析手法を紹介し、研究成果を基にAGEs阻害効果を有する食品成分を2つ紹介する。 AGEs分析手法のあれこれ我々が行なっているAGEsの分析法は、AGEs生成阻害の評価系とAGEsの定量系に大別することが出来る。AGEs生成阻害の評価系は、従来法としてグルコースとタンパク質の混合液に候補となる化合物を添加して8週間ほど37℃で保温してCMLおよびCMAの生成阻害の評価を行なっていたが、評価までに時間がかかるためスクリーニング実験などの多検体測定には不向きであった。そこで我々は、グルコースの代わりにリボースを用いることで1週間の保温期間で効率的にCMLおよびCMAの生成阻害評価を行うことが可能となることを見出し、AGEs阻害活性を持つ天然物のスクリーニングが飛躍的に簡便になった。AGEsの定量系は、主に液体クロマトグラフィータンデム質量分析装置(LC-MS/MS)を用いて絶対定量による評価を行なっている。合成したAGEs標準品に非放射性同位体で標識したものを内部標準として用い、複数の前処理ステップを経て、LC-MS/MSを使用して生体組織や血液からAGEsを定量している。また、AGEs特異的抗体を用いた相対定量による評価も行なっている。ELISA法やウエスタンブロット法では、AGEs標準品をキャリアタンパクと架橋させて免疫したいわば「特定のAGE構造を狙い撃ち」して得られた抗体が必要であり、抗体が認識するAGEs構造(エピトープ)が分かっていることが必須となる。当研究室は機器分析と高い相関性のある抗AGEs抗体を保有しており、相対評価であっても信頼性の高い結果が得られている。 マンゴスチンで潤う?皮膚の老化を防ぐロダンテノンBマンゴスチンの果実は広く食されているが、その果皮のお茶は飲んだことがあるだろうか?インドネシアやタイなどの東南アジアでは、乾燥させたマンゴスチンの果皮のお茶を嗜好品としてまたは民間薬として古くから用いてきた。 我々はこのマンゴスチン果皮の熱水抽出物に、分子間架橋作用をもつAGEsであるペントシジンの抑制効果があることを見出した12)。有効成分として同定された化合物はガルシマンゴソンD、ユークリフィン、ロダンテノンB、エピカテキンであり、ペントシジン形成をそれぞれ 38%、38%、45%、35% 阻害した(図4.1)。またボランティア被験者として11人の健康な女性にマンゴスチン果皮の熱水抽出物を3ヶ月間経口摂取してもらったところ、血清中のペントシジン量が減少し、皮膚中の蛍光性AGEsも減少した(図4.2)。さらには肌の弾力性と水分量も改善した。そして、血管の硬化度も改善し、動脈硬化などのリスクも改善する傾向がみられた13)。 これらのことから、マンゴスチンの果皮に含まれるガルシマンゴソンDやロダンテノンBなどのベンゾフェノン化合物にはコラーゲン分子間に好ましくない架橋をするAGEsの生成を阻害することで血管をしなやかに保ち、肌状態の改善にも効果があることが期待される。また熱水抽出物においてその効果が認められたことからも、摂取が容易なだけでなく、有効成分を抽出する際にもキャリーオーバーなどの懸念が少なく安全性が高いのが特徴である。 マンゴスチン果皮には、今回紹介した成分だけでなく他にも多数の有効成分が豊富に含まれており、その代表的なものとしてはポリフェノールがある14)。マンゴスチン果皮はその果実全体に占める重量が多く、未利用資源としてさらなる利用価値が広がっていくと期待される。
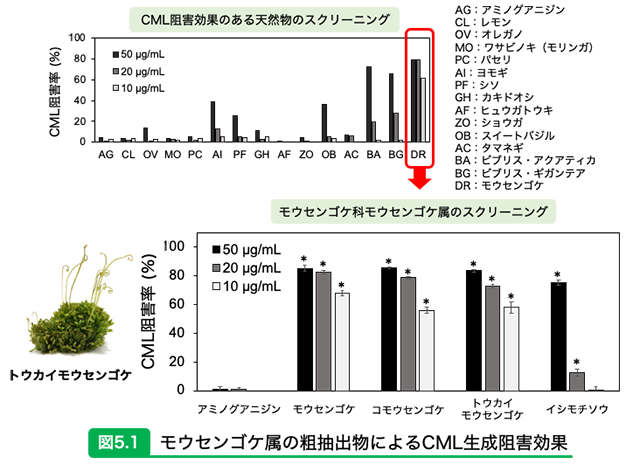
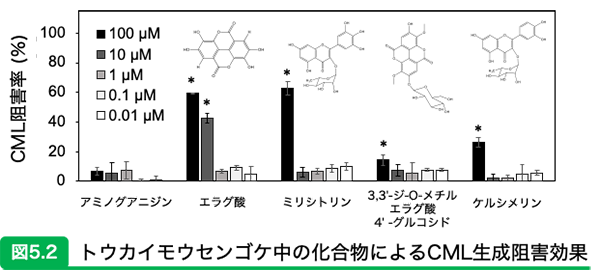
参考文献13)より一部改訂 食虫植物を薬用に?身体のサビを防ぐフェノール化合物食虫植物というとみなさんはどのようなイメージを持っているだろうか?とりもち式の罠で虫を捕まえて食べる、といったところではないか。食虫植物研究会の会誌によると、食虫植物のモウセンゴケを北半球では伝統的に薬用利用されてきたことが記されている。 我々は様々な天然物のなかでもモウセンゴケ科の食虫植物の粗抽出物に、AGEsであるCMLとCMAの生成阻害効果があることを見出した15)。詳しく調査すると、モウセンゴケ、コモウセンゴケ、トウカイモウセンゴケ、イシモチソウのモウセンゴケ属の4種の粗抽出物にはカルボニルトラップ剤(AGEsトラップ剤)として知られているアミノグアニジンよりも高い阻害効果を有することが明らかとなった(図5.1)。そのなかで日本にのみ自生しており、培養法が確立されていて入手が可能な「トウカイモウセンゴケ」に焦点を絞り、AGEs生成阻害成分の単離と同定を行った。その結果、エラグ酸、ミリシトリン、3,3' -ジ-O-メチルエラグ酸 4' -グルコシドそしてケルシメリンの4種のフラボノイド類が同定された。これらの化合物のAGEs生成阻害効果を評価した結果、エラグ酸とミリシトリンにおいて高い阻害効果が認められ、カルボニルトラップ作用ではなく抗酸化作用を介してCMLおよびCMA生成の阻害効果であることが示唆された(図5.2)。 これらのことから、トウカイモウセンゴケに含まれるエラグ酸とミリシトリンなどのフェノール化合物には、酸化ストレスによって生成が促進されるAGEsの生成を阻害することで身体のサビを防ぐ効果があることが期待される。 食虫植物のモウセンゴケは気管支炎症の伝統的な薬として古くからヨーロッパで利用されてきたが、近年は抗炎症効果があることも報告されている16)。またトウカイモウセンゴケが他のモウセンゴケ属よりもアレルギー抑制効果が高いことも報告されている17)。大量に培養が可能となれば煎じて飲用するだけでなく、ヨーロッパのようにハーブ入りのドロップとして、一般市場での価値が高まると期待される。
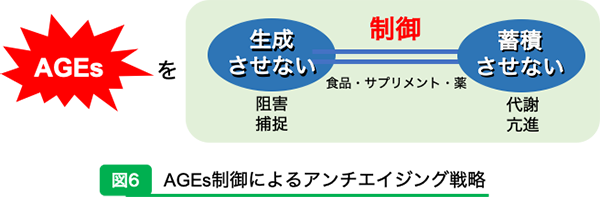
参考文献15)より一部改訂 おわりに(AGEsは善か?悪か?)本稿ではAGEsを阻害する食品成分に着目して話を進めてきた。ここで最後にみなさんにぜひお聞きしたいことがある。それは「AGEsを含む食品は善か悪か」ということである。 AGEsとアンチエイジングとの関係が注目されるようになってから、生体内で生成されるAGEsだけでなく食品中で生成されるAGEsも盛んに測定されている18)。食品の調理・加工・貯蔵の過程においてメイラード反応が起き、褐色色素であるメラノイジンや終末糖化産物であるAGEsが生成されるためである。近年では乳糖不耐症向けの乳製品において、CMLやCEL、MG-H1/H3がメイラード反応の程度を評価するマーカーとして利用できることが報告された19)。つまり、食品中のAGEsを測定することで加工食品の品質管理の指標となり得ることが示唆されたのである。実際に、日本のスーパーなどで売られている多数の清涼飲料水や加工食品にもAGEsは含まれている20)。食事からAGEsを摂取すると健常者では10%が血液中に移行し、48時間以内に尿中に排出されるものの約7%は残留していたとの報告があるため21)、生体への悪影響を予防するためには、AGEs 生成が少ない食品や調理・加工を選択する必要がある。 食品中のAGEsは加熱の温度や時間だけでなく、pHや脂質量、熟成や貯蔵によっても様々に変化する。日本の伝統的な調味料である味噌や醤油は高AGEs食品であるように22)、我々は食事からAGEsを日常的に摂取していることになる。しかしながら我々日本人の平均寿命は男性が81.47歳で世界3位、女性は87.57歳で世界1位であり23)、世界的に見ても長寿国である。一見パラドックスのようだ。その理由として考えられるのは、味噌や醤油などは高AGEs食品であると同時に高メラノイジン食品でもあり、メラノイジンの抗酸化作用をはじめ多数の生理活性24)によるものであると考えられる。さらにココアやコーヒー、パンに含まれるメラノイジンにはAGEsの前駆体であるα-ジカルボニル化合物のスカベンジャーとなることが報告されている25)。結果として日本の伝統食は高AGEs食品であるにも関わらずアンチエイジングにも役立っていたと考えられる。昨今、ファーストフードはAGEs含量が高くて体に悪いとも言われているが、例えばフライドポテトにはAGEsのみならず脂質過酸化物が多く、大切なビタミン類は加熱によって分解されているため、「AGEs含量が高いのでフライドポテトは悪」と決めつけるのは早急であろう。 AGEsには光と影がある。「AGEsを含む食品は善か悪か」という問いにも研究者によって見解が異なる。しかし、生体内で生成されたAGEsは悪の側面が強いことは確かなようだ。AGEsからみるアンチエイジングの戦略として、外因性や内因性そのどちらにおいてもAGEsの生成阻害や生成したAGEsの捕捉、代謝亢進など、うまく制御する手がかりが解明されれば、アンチエイジングへの道が大きく開かれる(図6)。現在、食品中のAGEsにも生体内のAGEsにも構造や機能、影響が明らかになっていない部分が多いため、今後の研究に期待したい。
文献
略歴
永井 竜児(ながい りょうじ) 東海大学農学部・食生命科学科・教授 東海大学大学院・農学研究科・教授 東海大学大学院・生物科学研究科・教授
1993年 静岡県立大学大学院 生活健康科学研究科 修士課程(食品栄養学専攻) 1995年 熊本大学大学院 医学研究科 入学(生理系専攻) 1999年 熊本大学 医学部 生化学第二講座・助手 2002年 サウスカロライナ大学・化学及び生化学科 客員研究員 2004年 熊本大学大学院 医学薬学研究部 病態生化学講座(旧生化学第二講座)・助手 2007年 熊本大学大学院 医学薬学研究部 病態生化学講座・助教 2009年 日本女子大学 食物学科生化学・食品機能科学・講師 2012年 東海大学 農学部 バイオサイエンス学科 食品生体調節学研究室・准教授 2017年 東海大学 農学部 バイオサイエンス学科 食品生体調節学研究室・教授
1. 日本メイラード学会・評議員 2. 国際メイラード学会・評議員 3. 腎とフリーラジカル研究会・評議員 4. 日本酸化ストレス学会・評議員 5. 日本抗加齢医学会・評議員
趣味:水泳と愛犬ペシャとの散歩
山口 広子(やまぐち ひろこ) 東海大学大学院 生物科学研究科 生物科学専攻
2012年 鹿児島大学大学院 農学研究科 生物資源化学専攻 修士課程 2012-2017年 学校法人 東海大学 専任技術職員 2017年より 東海大学大学院 生物科学研究科 生物科学専攻 博士課程 (在学中) サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |