|
半致死的ストレス条件下における細菌細胞の形態変化とその問題点
北海道大学大学院水産科学研究院水産食品科学分野
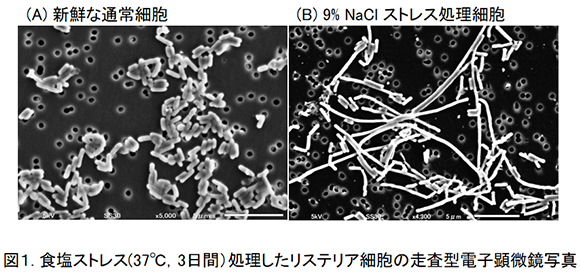
教授 山崎 浩司 助教 山木 将悟 1. はじめに食品における微生物制御では,加熱や乾燥,冷却処理をはじめ,pH調整,水分活性調整,食品保存料や日持ち向上剤の添加などの微生物制御技術を利用すれば,食品の品質劣化防止と安全性維持は可能である。しかし,実際の加工食品において,付着微生物に対して強度の高い致死的な微生物制御技術(ストレス)を与え,完全に微生物を殺滅することは食品の品質劣化に繋がってしまう。そこで品質を保持しながら微生物を効率良く制御するためにハードル理論に基づく複合的な微生物制御法が利用されている1)。しかし,品質を最優先して微生物制御のためのストレス強度を弱くすると半致死的なストレスを受けた微生物,すなわち損傷菌が生残してしまうことになる。損傷菌は,健常な細胞とは様々な点で異なる性質,例えば薬剤に対する感受性が増大していることなどが知られるようになり,食品微生物制御および食品微生物検査の場面において非常に興味を持たれるようになった2)。本稿では,食品加工において使用される微生物制御技術を使用した時に発生する損傷リステリアの発生状況を調べていた時に見られた特異な細胞形態の変化(フィラメント形成)3)とその問題点を紹介する。 2.半致死的なストレス処理による細菌の形態変化水産食品の製造工程を想定した微生物制御処理によるリステリア(Listeria monocytogenes)の損傷菌について発生状況を調査している時,特異な細胞形態の変化について学生から相談を受けた。すなわち,リステリアの細胞を高濃度食塩存在下(9% NaCl,水分活性=0.94)の液体培地で保持した時に細胞が極めて長く伸長する現象である。同様の細胞形態の変化は寒天平板上でも認められ(図1),
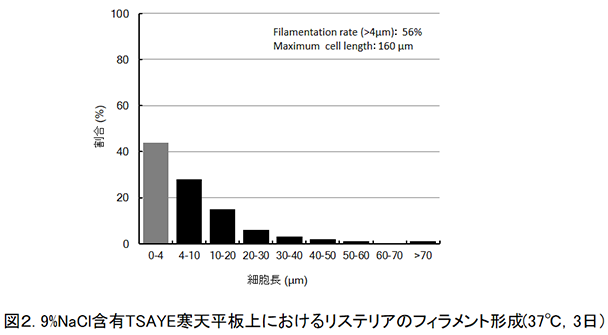
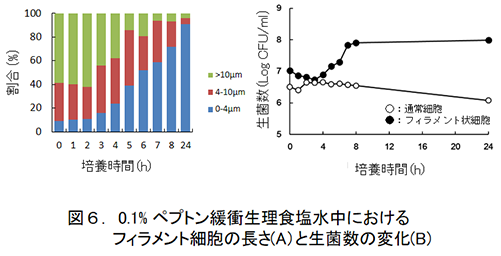
この時に形成されたリステリア細胞の長さは160µmのものを最長とし,4µm以上(リステリアの通常細胞長:1〜2µm4)であるため,著者らは3個以上の細胞長となっているものをフィラメント状と定義)の長さの細胞が全体の50%以上を占めていた(図2)。
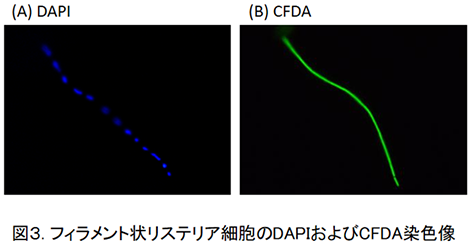
この伸長したリステリア細胞を4',6-ジアミジノ-2-フェニルインドール(DAPI)で染色すると細胞内にDAPIで染色された核酸が不均一に見られ(図3(A)),CFDA染色によって細胞内酵素(エステラーゼ)の活性を見るとフィラメント細胞全体から蛍光が観察された(図3(B))。
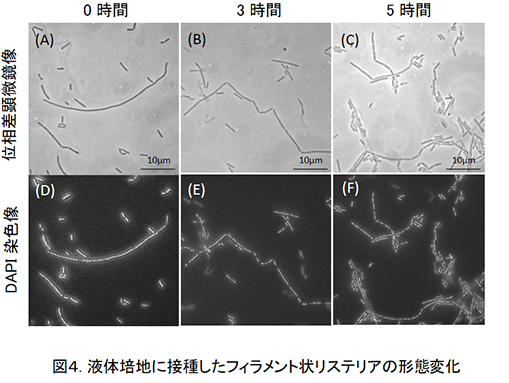
また,SynaptoRed C2で細胞膜を染色するとDAPI染色で染色されないところに細胞膜のある様子が認められた(本稿ではデータ非公表)3)。次に,この伸長した細胞を栄養豊富な液体培地に接種し保持すると時間の経過につれてDAPIによって染色される部位が明瞭に分かれはじめた(図4-B,C,E,F)。
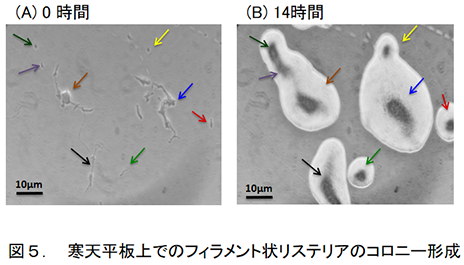
したがって,この高濃度食塩というストレス条件下で伸長した細胞は一つの細胞が伸長したものではなく,個々の細胞が分断せずに多数連なった数珠状(フィラメント状)であることが判明した。新鮮培養したリステリア細胞の長さは1〜2µmであるため,この実験において最大長を示したフィラメント状の細胞には理論的に考えると80〜100個の細胞が連なって形成されていることになる。このようなリステリア細胞の伸長は,他の研究者も食塩ストレスだけでなくアルカリストレス5)や酸ストレス6)などによる非致死的なストレス処理条件下においても発生することを報告している。また,非致死的ストレス環境下における細菌細胞の伸長は大腸菌やサルモネラ,モルガネラなどの細菌でも見られるとされている7-11)。著者らも,非致死的な食塩ストレス処理だけでなく,有機酸でpH調整した培地におけるリステリア細胞の形態変化を調べ,食塩ストレス時と同様な現象の起こることを確認している。さらに,嫌気条件下よりも好気条件下においてこのフィラメント形成が顕著に発生することも明らかになっている。リステリアの発育限界食塩濃度は10%(水分活性=0.92)であり12),9%NaCl環境はリステリアにとって発育可能な食塩濃度の上限に極めて近い環境である。有機酸の場合においても発育阻止の起こる条件に近いストレス強度の処理によって細胞の伸長は発生し,また有機酸の種類によってその伸長程度が異なっていた。食品微生物制御に当たって,水分活性とpHの調整や酸素分圧の調整は常用される制御法であり,一般にはこれらの組み合わせが使用される。よって,不適切な微生物制御のストレス強度の場合,食品に生残した細菌が保存中にこのような細胞形態の変化を起こしている可能性が考えられる。著者らは,細菌の細胞形態がフィラメント状へ変化することも,通常細胞における細胞分裂に関わる機能のいずれかが損傷するために発生する現象と考えられ,損傷菌の一つとして考えている。 3.細菌の形態変化による微生物制御での問題点食品に付着する細菌の細胞がフィラメント状に伸長した場合,食品微生物検査で常用される寒天平板法による生菌数測定への影響が推察される。このフィラメント状の細胞は,ボルテックス処理や超音波処理を行っても分断しないため,寒天平板培地へ播種すると多数の細胞が連なった一つの長いフィラメント状細胞は通常検査においては一つのコロニーとしか計測できない(図5)。
したがって,食品内で微生物制御のために行ったストレス処理によって細菌の細胞がフィラメント状に形態変化してしまうと平板培養法による生菌数測定では正確な生細胞数の測定ができていないということになる。
次に,このフィラメント状の細胞はストレスを除去した環境に移すと比較的短時間のうちにフィラメン内で新たな隔壁が形成されながら通常の細胞と同様な分裂を開始してしまう(図4)。また,このフィラメント状細胞の通常サイズへ戻る現象は,増殖には不十分な栄養分しかない環境でも起こってしまうことが明らかになっている(図6)。
例えば,日本でも平成26年12月にリステリアの規格基準が非加熱食肉製品(生ハムなど)とナチュラルチーズ(ソフトおよびセミハードのものに限り,また容器包装に入れた後,加熱殺菌したもの,または飲食に供する際に加熱するものは適用外)に検体1g当たり100以下の規格値が設定され13),リステリアの定量法には損傷菌の回復を目的とした蘇生培養を行った後に酵素基質培地を用いた平板培養法による生菌数測定が採用されている14)。したがって,この標準法における蘇生培養はフィラメント状になってしまったリステリアでの生細胞数をより正確に測定するためにも有効な処理法と言える。
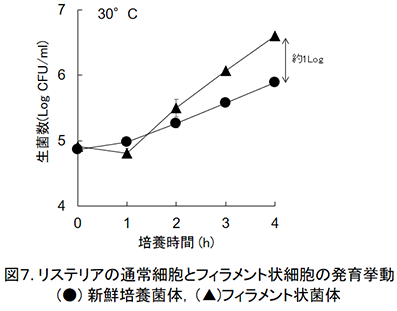
また,食品における実際の微生物制御について考えた場合,各食品における制御対象微生物を特定し,その汚染菌量と保存環境(温度やpH,水分活性等)における発育動態を考慮して制御強度が設定される。一般的には,制御対象菌の汚染菌量が少なければ微生物制御のための強度を弱めることができ(例えば,食品保存料なら添加量を少なくできる),食品の品質向上へ繋げられる。しかし,前述のように,フィラメント状となった細菌細胞が食品に存在している場合,平板培養法で測定した汚染菌量を基準とした殺菌および制御条件の決定では生細胞数を正確に把握できないため,期待していたような効果が得られないことが考えられる。実際に,生菌数測定によって初発菌数が同等となるようにリステリアの通常細胞とフィラメント状細胞を発育可能な培地に接種し,経時的な菌数測定を行うと,数時間後にはフィラメント状細胞を接種した試験区では,新鮮培養菌体を接種したものの約10倍の生菌数となった(図7)。
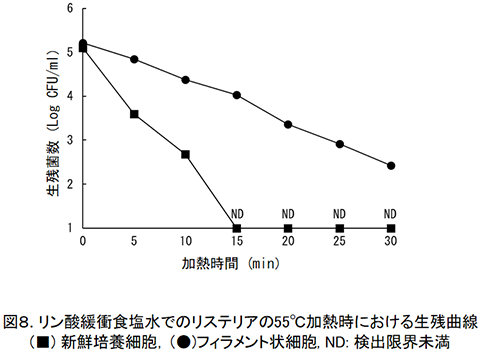
さらに,フィラメント状リステリア細胞の55℃での生残菌数を寒天平板法で調べてみると,新鮮培養菌体では加熱時間の経過とともに生残菌数の著しい減少(5 Log CFU/ml以上)が見られたが,フィラメント状細胞では加熱30分後においても生菌数は約2 Log CFU/mlの減少しか認められなかった(図8)。
この場合,フィラメント状細胞に存在する生細胞数が多いためにこのような結果が得られたのか,フィラメント状細胞を構成する個々の細胞の耐熱性が上昇したためなのかはまだ明らかではないが,通常細胞の特性を基に設定した微生物制御条件では期待通りの微生物制御効果が得られないことを証明している。 4.おわりに加工食品における微生物学的なトラブルは,新しい知見や技術の集積によって極めて少なくなっていることは事実である。しかし,昨今の食品製造の現場では,食品素材の持つ風味,食感,色調などの特性を高いレベルで残すために,微生物制御に関わるストレス強度を最小限にした食品も見受けられるとともに,食品の保存期間も長くなる傾向にある。食品に存在する細菌を確実に制御するためには,このようなフィラメント状となった細胞内に存在する個々の細胞の特性を明らかにするとともに,生細胞数を正しく測定する方法の開発も食品での微生物トラブルを回避するために重要な事象と考えられる。 引用文献
略歴山崎 浩司 北海道大学大学院水産科学研究院水産食品科学分野 教授
1993年 北海道大学水産学部 助手 1998年 北海道大学水産学部 助教授 2007年 北海道大学大学院水産科学研究院 准教授 2021年 北海道大学大学院水産科学研究院 教授 現在に至る
山木 将悟 北海道大学大学院水産科学研究院水産食品科学分野 助教
2014年 北海道大学大学院水産科学院 博士前期課程 修了 2016-18年 日本学術振興会特別研究員 DC2およびPD 2017年 北海道大学大学院水産科学院 博士後期課程 修了 2018年 北海道大学大学院水産科学研究院 助教 現在に至る サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |