| ◆ HOME >分岐鎖アミノ酸(BCAA):代謝特性と生理機能 |
 |

分岐鎖アミノ酸(BCAA):代謝特性と生理機能
 中部大学 応用生物学部 食品栄養科学科
教授 下村 吉治
1. はじめに
生物の体内でタンパク質合成に利用される20種類のα-アミノ酸のうち、3種類(L-ロイシン、L-イソロイシン、L-バリン(以降はL-を省略):図1)は側鎖に分岐構造を持つため分岐鎖アミノ酸(branched-chain amino acids: BCAA)と総称される。
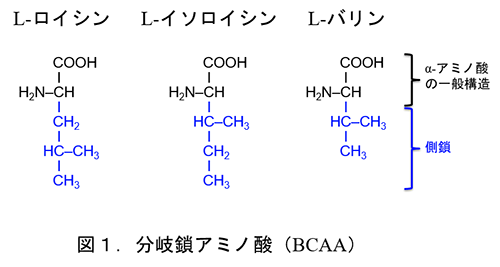
BCAAはいずれもヒトの体内では合成されないため、栄養学的な不可欠(必須)アミノ酸である。ヒトはタンパク質を摂取することにより必要なBCAAを獲得しているが、食品タンパク質中のBCAAの含量は比較的高く、タンパク質の総アミノ酸の20%前後である(表1)。
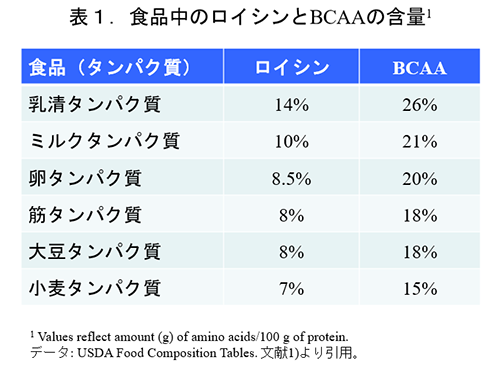
食品タンパク質の中でも特に乳清タンパク質においてBCAA含量が高いことが知られているため、BCAAの生理作用を期待する場合には乳清タンパク質が多く使用される。
上記のようにタンパク質には多くのBCAAが含まれるが、ヒトの組織内には遊離のアミノ酸(アミノ酸プール)が存在し、タンパク質合成等に利用される。この遊離アミノ酸を最も多く含む組織は、体重に占める割合が高い骨格筋である。報告されている骨格筋の遊離アミノ酸濃度(表2)2)では、グルタミンとタウリン(アミノ酸類似物)濃度が非常に高いが、BCAA濃度はわずかに全体の1%程度に過ぎない。

血液中にも骨格筋と同程度の遊離BCAAが存在するが、タンパク質またはBCAAサプリメント等の摂取によりその濃度はかなり急峻に上昇する3)。それによりBCAAの生理作用が発揮されることになる。
以下には、ヒトを含めた哺乳動物のBCAA代謝(分解)の特徴と、これまでに明らかにされているBCAAの主な生理作用について解説する。
2. BCAA代謝の調節
ヒトを含む哺乳動物では、BCAA分解(代謝)系が存在し、その主要な系はミトコンドリア内に局在する。この分解系では、最初の2つのステップの反応は全てのBCAAに共通であり、それ以降の分解系はそれぞれのBCAAに固有の系が存在する(図2)4)。
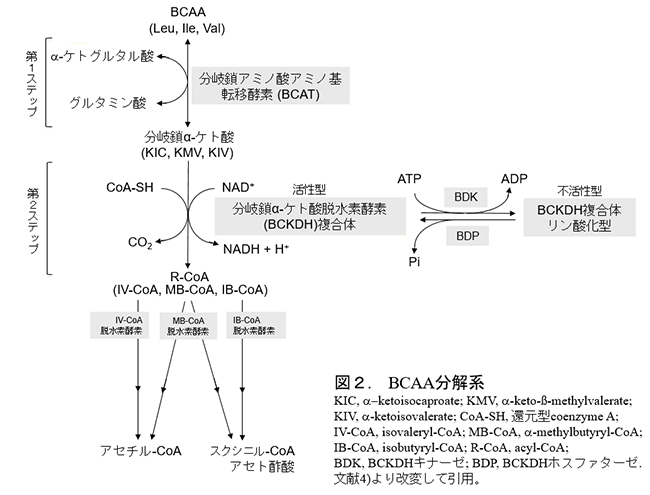
第1ステップは、BCAAアミノ基転移酵素(branched-chain aminotransferase: BCAT)により触媒される可逆的なアミノ基転移反応であり、それぞれのBCAAから分岐鎖α-ケト酸(branched-chain α-keto acids: BCKA)を生成する。BCATには2つのアイソザイムが存在し、一つは肝臓以外の体組織で発現しているミトコンドリア型(BCATmまたはBCAT2)であり、他の一つは主に脳等の一部の組織のみに発現している細胞質型(BCATcまたはBCAT1)である5)。上述のように、BCATmはほぼ全身組織で発現しているのでこのアミノ基転移のための主要な酵素であるが、肝臓は例外であり直接BCAAを分解できない。一方、筋肉や膵臓ではBCATmの発現は高いので6)、BCAA分解の主要臓器は、肝臓外の筋肉等の組織である7)。この特徴は、他の必須アミノ酸が全て肝臓で分解される点と著しく異なる。ただし、これまでに報告されているヒトBCATmの各BCAAに対する親和性は低いため(Km値:0.6〜3 mMの範囲)4)、BCATmは食後等の血漿BCAA濃度が上昇した時のみに作用すると推察される。
第2ステップは、BCKA脱水素酵素 (branched-chain α-keto acid dehydrogenase: BCKDH)複合体により触媒されるBCKAの酸化的脱炭酸反応である。この反応は不可逆的であるため、BCAA分解を律速すると考えられている。この酵素は、脳内の一部の細胞を除いて全身組織で発現しており、特にラット・マウスの肝臓での活性は著しく高い4)。肝臓ではBCAAを直接分解できないが、第2ステップ以降の反応を触媒する酵素は全て高発現しているので、BCKAを代謝できる。BCKDH複合体のそれぞれのBCKAに対する親和性は高いため(Km値:20〜40 µM)8)、BCATmにより生成されたBCKAは直ちに代謝される。
さらに、BCKDH複合体は酵素タンパク質のリン酸化・脱リン酸化による活性調節を受けるので、酵素活性の速やかな調節が可能である。BCKDH複合体をリン酸化により不活性化する酵素がBCKDH kinase (BDK)であり、脱リン酸化により活性化する酵素がBCKDH phosphatase (BDP)である(図2)9)。この2つの酵素の中でもBCKDH活性を強力に調節するのはBDKであることが分かっている7,9)。
血中のBCAA濃度の調節機構はまだ十分に明らかにされてないが、全身組織でのBCATm欠損は血漿BCAA濃度を10倍以上に上昇し10)、反対にBDK欠損によるBCKDH複合体の慢性的活性化(BCAA分解亢進)は血漿BCAA濃度を半分以下に低下するので11) 、その機構には組織のBCATmとBCKDH複合体の活性が重要な働きをしているようである。さらに、筋特異的なBDK欠損では、血漿BCAA濃度は30%ほど低下するので12)、筋組織はBCAA代謝調節の重要な組織と考えられる。
3. タンパク質代謝を調節するロイシン
組織中(特に筋組織)のBCAA濃度は血中BCAA濃度の上昇とともに増大し、BCAAの中でも特にロイシン濃度の上昇はタンパク質代謝に強い影響力を持つ。このロイシンの作用機構は図3に示すように説明されている。
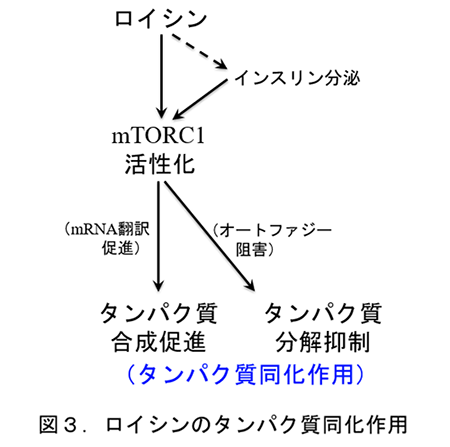
すなわち、ロイシンは、動物の細胞内に存在するタンパク質キナーゼの1つであるmTORC1(mammalian target of rapamycin complex 1)を活性化(リン酸化)し、次いでmTORC1は翻訳開始因子であるeIF4E結合タンパク質(eIF4E-BP1)のリン酸化およびリボソームタンパク質S6に対するキナーゼ(S6K1)をリン酸化することにより、mRNA翻訳(タンパク質合成)を促進する13)。一方、活性化されたmTORC1はリソゾーム系のタンパク質分解機構であるオートファジーを阻害してタンパク質分解を抑制することが明らかにされている13)。これらの機構によりロイシンはタンパク質同化作用を示す。さらに、ロイシンは同化ホルモンであるインスリンの分泌も刺激するので、インスリンを通してmTORC1活性化を促進する(図3)。すなわち、ロイシンはタンパク質合成の材料であるばかりでなく、タンパク質代謝を同化に傾ける強力な因子である。ロイシンのこの作用に基づき、BCAAはスポーツにおける筋肉づくりのためのサプリメントとして注目されており、BCAAを多く含むタンパク質の乳清タンパク質(表1)は「プロテイン製品」の主原料として多用されている。さらに、BCAAは臨床的にも肝硬変患者の低アルブミン血症改善薬として使用されている14)。
ただし、体内のロイシン濃度が上昇すると、ロイシンから生成されるBCKA(α-ケトイソカプロン酸)がBDKを阻害するため9)、BCKDH複合体が活性化されてBCAA分解は促進される。このBCAA代謝の調節機構により、体内の過剰なBCAAは、速やかに代謝されるので、タンパク質合成の刺激は長時間持続しない仕組みとなっている。
4. インスリン抵抗性とBCAA
インスリン抵抗性とは、インスリンに対する感受性が低下しインスリン作用が十分に発揮されない状態を指し、肥満・2型糖尿病において認められる。およそ50年前に、肥満者の空腹時血漿BCAA濃度は上昇していることが報告され15,16)、それ以降インスリン抵抗性を共通の特徴とする肥満・2型糖尿病では血漿BCAA濃度が上昇することがヒトおよび実験動物(Zuckerラット、食餌性肥満ラット、ob/obマウス)で知られるようになった17)。この血漿BCAA濃度の上昇は、ヒトで20~30%程度、マウス・ラットで50%前後である17,18)。肥満および2型糖尿病における血漿BCAA濃度の上昇は、インスリン抵抗性のHOMA-IR指数18)およびヘモグロビンA1c (HbA1c)濃度17)と正相関するため興味深い現象である。このインスリン抵抗性と血漿BCAA濃度の上昇をヒトとラットにおいて再解析し、上昇したBCAA濃度がインスリン抵抗性の原因物質である可能性を示唆する論文が2009年に報告された18)。それ以降、この論文の仮説を支持する多くの論文が発表されているが、今だにそれを直接証明した研究はない。
その一方で、インスリン抵抗性とBCAAの関係について、むしろ上記の仮説とは相反する多くの所見が報告されており、これらの論文ではBCAAはインスリン抵抗性を改善するとしている。以下にこれらの論文の所見を列記した。
- (1) 正常ラットにBCAA添加食を長期投与すると血清インスリン濃度は低下する傾向にあった19)。
- (2) 重度の2型糖尿病状態のラット(Zucker Diabetic Fattyラット)では血漿BCAA濃度は上昇するが、緩徐に症状が進展する自然発症2型糖尿病ラット(Otsuka Long-Evans Tokushima Fatty (OLETF)ラット)の血漿BCAA濃度は高インスリン血症であっても必ずしも上昇しない20)。
- (3) OLETFラットにBCAA添加食を長期投与すると肝BCKDH複合体活性の上昇と共に耐糖能が一部改善した20)。
- (4) BCAAアミノ基転移酵素BCATm欠損マウスでは、著しい血漿BCAA濃度の上昇と共にインスリン感受性が顕著に改善された10)。
- (5) 高脂血症薬でありBDK阻害剤であるクロフィブラート投与によりラットの血漿BCAA濃度を低下させた状態では耐糖能が低下し、そのラットにBCAAを経口投与して血漿BCAA濃度を回復させると耐糖能も回復した21)。
- (6) 肥満ラットにインスリン抵抗性改善薬(ピオグリタゾン、ロシグリタゾン、トログリタゾン、AG-035029)を投与したときのインスリン感受性の改善は、脂肪組織のBCAA代謝系酵素の発現増加と正相関した22)。
- (7) 岐阜県高山市の13,525名を対象としたコホート研究で、高BCAA摂取は糖尿病発症リスクと逆相関した23)。
- (8) 一卵性双生児におけるコホート研究で、遺伝的要因に関係なく、高BCAA摂取はインスリン抵抗性と逆相関した24)。
- (9) 糖尿病発症前の肥満者12名を被験者として、1日に20 g BCAAを4週間投与するクロスオーバー試験では、BCAA投与は肥満者の糖代謝を損なうことはなく、むしろ改善する傾向にあった25)。
以上のように、インスリン抵抗性により血中BCAA濃度は上昇する傾向にあるが、BCAAを投与するとそのインスリン感受性は改善される傾向にあると結論されている。少なくとも血中BCAA濃度の上昇がインスリン抵抗性発症の原因とは考え難い。
5. 脳機能とBCAA
グルタミン酸は脳内で興奮性の神経伝達物質として機能しており、脳内で活発に合成されている。グルタミン酸は、α-ケトグルタル酸にアミノ基が転移されて合成されるが、脳ではこのアミノ基の多く(約25%)はロイシンから供給されると推定されている26)。上記のように、BCAA分解はBCKDH複合体により調節されるので、BDK欠損マウスではBCKDH複合体の活性化によりBCAA分解が亢進する。全身組織のBDK欠損マウス(BDK-KOマウス)が作製され、このマウスでは脳内のBCAA濃度は正常マウスの約1/3に低下していた11)。正常マウスでは尾懸垂テストにおいて後肢を広く開くのに対して、このBDK-KOマウスでは後肢を閉じて体幹に引き寄せる行動を示したので、このマウスは脳神経系に異常を持つことが判明した。実際に、成長後のこのマウスはストレス負荷により癲癇発作を起こした11)。最近の我々の研究において、マウス前頭葉の神経細胞特異的にBDKを欠損すると、このマウスは尾懸垂テストで同様の行動を示すことが判明したので、脳におけるBCAA不足が神経異常を引き起こす原因であることが判明した27)。
BDK-KOマウスが作製されたことはヒトのBDK遺伝子変異を発見することにも貢献した。この遺伝子異常を持つヒトがトルコ、エジプト、リビアに在住する3つの家系において発見され、いずれも知的障害を持つ自閉症患者であった28)。これらの患者はBDK-KOマウスと同様に癲癇を起こした。これらの患者の線維芽細胞ではBDKが検出されず、血漿BCAA濃度が著しい低値であった。すなわち、低BCAA血症の状態で成長することにより癲癇を起こす自閉症患者になったと推察される。さらにBDK-KOマウスを用いた研究で、BCAAを過剰に投与すると後肢を開くようになり癲癇発作を起こさなくなったので、BDK欠損による自閉症はBCAA投与により治療できる可能性が指摘された28)。実際に、BDK欠損の自閉症患者に、高タンパク質食とBCAAサプリメントを摂取させると症状が改善することも報告されている29)。
以上のように、BCAAの生理作用は多様である。今後さらに研究が進み、新たなBCAAの生理機能が発見される可能性は高い。読者の皆様には、BCAA(および食事タンパク質)の摂取量について見直して頂き、その十分量の摂取に心がけて頂くきっかけとして本書が貢献できれば著者の望外の喜びである。
文献
- 1) Layman DK, Baum JI. (2004) Dietary protein impact on glycemic control during weight loss. J Nutr. 134, 968S-973S.
- 2) Rennie MJ. (1996) Influence of exercise on protein and amino acid metabolism, In: Handbook of Physiology. Rowell LB, Shepherd JT, eds, Section 12: Exercise: Regulation and Integration of Multiple Systems, Oxford University Press, New York, p995-1035.
- 3) Matsumoto T, et al., (2014) Bolus ingestion of individual branched-chain amino acids alters plasma amino acid profiles in young healthy men. SpringerPlus. 3, 35.
- 4) 下村吉治. (2009) 分岐鎖アミノ酸(BCAA)代謝の調節機構.化学と生物.47, 480−485.
- 5) Hutson SM, et al., (1998) Role of branched-chain aminotransferase isoenzymes and gabapentin in neurotransmitter metabolism. J Neurochem. 71, 863-874.
- 6) Suryawan A, et al., (1998) A molecular model of human branched-chain amino acid metabolism. Am J Clin Nutr. 68, 72-81.
- 7) Neinast MD, et al., (2019) Quantitative analysis of the whole-body metabolic fate of branched-chain amino acids. Cell Metab. 29, 417-429.
- 8) Shimomura Y, et al., (1987) Purification of branched chain α-ketoacid dehydrogenase complex from rat liver. Anal Biochem. 163, 74-78.
- 9) Shimomura Y, et al., (2006) Branched-chain amino acid catabolism in exercise and liver disease. J Nutr. 136, 250S-253S.
- 10) She P, et al., (2007) Disruption of BCATm in mice leads to increased energy expenditure associated with the activation of a futile protein turnover cycle. Cell Metab. 6, 181-194.
- 11) Joshi MA, et al., (2006) Impaired growth and neurological abnormalities in branched-chain alpha-keto acid dehydrogenase kinase-deficient mice. Biochem J. 400, 153-162.
- 12) Ishikawa T, et al., (2017) Muscle-specific deletion of BDK amplifies loss of myofibrillar protein during protein undernutrition. Sci Rep. 7, 39825.
- 13) Hands SL, et al., (2009) mTOR's role in ageing: protein synthesis or autophagy? Aging. 1, 586-597.
- 14) Kawaguchi T, et al., (2011) Branched-chain amino acids as pharmacological nutrients in chronic liver disease. Hepatology. 54, 1063-1070.
- 15) Adibi SA. (1968) Influence of dietary deprivations on plasma concentration of free amino acids of man. J Appl Physiol. 25, 52-57.
- 16) Felig P, et al., (1969) Plasma amino acid levels and insulin secretion in obesity. N Engl J Med. 281, 811-816.
- 17) Lynch CJ, Adams SH. (2014) Branched-chain amino acids in metabolic signalling and insulin resistance. Nat Rev Endocrinol. 10, 723-736.
- 18) Newgard CB, et al., (2009) A branched-chain amino acid-related metabolic signature that differentiates obese and lean humans and contributes to insulin resistance. Cell Metab. 9, 311-26.
- 19) Shimomura Y, et al., (2000) Suppression of glycogen consumption during acute exercise by dietary branched-chain amino acids in rats. J Nutr Sci Vitamimol. 46, 71-77.
- 20) Kuzuya T, et al., (2008) Regulation of branched-chain amino acid catabolism in rat models for spontaneous type 2 diabetes mellitus. Biochem Biophys Res Commun. 373, 94-98.
- 21) Kadota Y, et al., (2012) Clofibrate-induced reduction of plasma branched-chain amino acid concentrations impairs glucose tolerance in rats. JPEN J Parenter Enteral Nutr. 36, 337-343.
- 22) Hsiao G, et al., (2011) Multi-tissue, selective PPARγ modulation of insulin sensitivity and metabolic pathways in obese rats. Am J Physiol Endocrinol Metab. 300, E164-E174.
- 23) Nagata C, et al., (2013) Branched-chian amino acid intake and the risk of diabetes in a Japanese community: the Takayama study. Am J Epidemiol. 178, 1226-1232.
- 24) Jennings A, et al., (2016) Associations between branched chain amino acid intake and biomarkers of adiposity and cardiometabolic health independent of genetic factors: A twin study. Int J Cardiol. 223, 992-998.
- 25) Woo SL, et al., (2019) Effects of branched-chain amino acids on glucose metabolism in obese, prediabetic men and women: a randomized, crossover study. Am J Clin Nutr. 109, 1566-1577.
- 26) Yudkoff M. (2017) Interactions in the Metabolism of Glutamate and the Branched-Chain Amino Acids and Ketoacids in the CNS. Neurochem Res. 42, 10-18.
- 27) Mizusawa A, et al., (2020) BDK deficiency in cerebral cortex neurons causes neurological abnormalities and affects endurance capacity. Nutrients. 12, 2267.
- 28) Novarino G, et al., (2012) Mutations in BCKD-kinase lead to a potentially treatable form of autism with epilepsy. Science. 338, 394-397.
- 29) García-Cazorla A, et al., (2014) Two novel mutations in the BCKDK (branched-chain keto-acid dehydrogenase kinase) gene are responsible for a neurobehavioral deficit in two pediatric unrelated patients. Hum Mutat. 35, 470-477.
略歴

1983年名古屋大学大学院 医学研究科博士課程修了(医学博士)、同年名古屋大学医学部助手、1987年筑波大学体育科学系講師、1992年名古屋工業大学工学部助教授、1997年同教授、2008年名古屋大学大学院生命農学研究科教授、2019年より現職。
この間、日本アミノ酸学会会長(2011-2014年)および日本栄養・食糧学会会長(2016-2017年)を歴任。
2011年日本栄養・食糧学会賞受賞。
|







