|
腸内細菌による食事脂質の代謝と代謝物の生理機能
京都大学大学院農学研究科
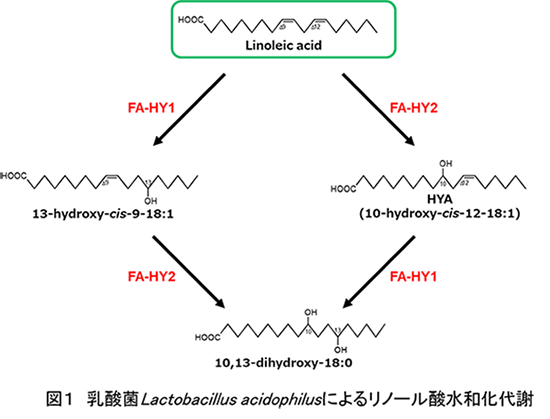
准教授 岸野 重信 はじめに我々が食事より摂取する脂質(トリアシルグリセロール)は、炭素数18の飽和脂肪酸であるステアリン酸(octadecanoic acid (18:0))や二重結合が1つのオレイン酸(cis-9-octadecenoic acid (18:1))、二重結合が2つのリノール酸(LA, cis-9,cis-12-octadecadienoic acid (18:2))、二重結合が3つのα-リノレン酸(cis-9,cis-12,cis-15-octadecatrienoic acid (18:3))やγ-リノレン酸(cis-6,cis-9,cis-12-18:3)、さらに魚油に特徴的に存在する炭素数20のEPA (cis-5,cis-8,cis-11,cis-14,cis-17-eicosapentaenoic acid (20:5)) や炭素数22のDHA (cis-4,cis-7,cis-10,cis-13,cis-16,cis-19-docosahexaenoic acid (22:6))などがある。これらの脂質は、宿主の膵リパーゼにより遊離脂肪酸とモノアシルグリセロールとに分解され小腸で吸収されたのち、トリアシルグリセロールへと再構築されリンパ管を経て全身に運ばれる。各組織へ供給された脂肪酸のうちω6脂肪酸であるリノール酸は、宿主の代謝(鎖長延長反応と不飽和化反応)により炭素数20のアラキドン酸(ARA, cis-5,cis-8,cis-11,cis-14-eicosatetraenoic acid (20:4))へ変換されたのち、さらに宿主の代謝を受けプロスタグランジン、トロンボキサチン、ロイコトリエンなど、一連のエイコサノイドへ変換される。また、ω3脂肪酸であるα-リノレン酸は、同様に宿主の代謝(鎖長延長反応と不飽和化反応)により炭素数20のEPAや炭素数22のDHAへ変換される。EPA、DHAはさらに宿主による代謝を受け、様々な生理機能を有する代謝物へと変換される。例えば、宿主由来P450モノオキシゲナーゼCYPにより、EPAが17,18-epoxy-cis-5,cis-8,cis-11,cis-14-eicosatetraenoic acid (20:4) (17,18-EpETE)へ、CYPならびに宿主由来リポキシゲナーゼLOXによりEPA、DHAがレゾルビン類へ代謝され、それぞれ脂質メディエーターと称されるシグナル分子として重要な役割を担っている。このように食事により摂取した脂肪酸が、宿主により様々な代謝物へ代謝され、さらにその代謝物の重要性が認識されている。 一方、腸内細菌が宿主の健康に寄与することが近年盛んに報告されているが、どのようなメカニズムで宿主の健康に寄与しているかを明らかにしている報告例は少ない。 我々は、食事由来脂質が腸内細菌によってどのように代謝されるのか、さらにその代謝物が宿主にどのような影響を与えるのかについて検討を行った。 1. 腸内細菌による不飽和脂肪酸代謝1.1水和化代謝 小腸に存在が確認されている腸内細菌の一種である乳酸菌Lactobacillus acidophilusが、リノール酸やα-リノレン酸のΔ9位およびΔ12位の二重結合をそれぞれ水和し、様々な水酸化脂肪酸へ代謝することを見いだした(図1はリノール酸を基質とした代謝経路)。
本乳酸菌より、水和化代謝に関わる酵素の特定を試みたところ、本乳酸菌は、異なる位置の二重結合を認識する2つの水和酵素(FA-HY1およびFA-HY2)を有していることを明らかにした。得られた精製酵素を用いて基質特異性を調べたところFA-HY1は、炭素数18でΔ12位にcis型二重結合を有する遊離型の不飽和脂肪酸(リノール酸、α-リノレン酸、γ-リノレン、ステアリドン酸(cis-6,cis-9,cis-12,cis-15-octadecatetraenoic acid (18:4))など)のΔ12位の二重結合を認識しC13位に水酸基を導入すること、さらにDHAに対してはC14位に、アラキドン酸に対してはC15位に水酸基を導入することを明らかにした。またFA-HY2は、炭素数18でΔ9位にcis型二重結合を有する遊離型の不飽和脂肪酸(オレイン酸、リノール酸、α-リノレン酸、γ-リノレン酸、ステアリドン酸など)のΔ9位の二重結合を認識しC10位に水酸基を導入することを明らかにした1)。 さらに腸内細菌であるClostridium属細菌の一種が、α-リノレン酸、EPA、DHAなど様々な不飽和脂肪酸を水和し、様々な水酸化脂肪酸を産生することも見いだしている。 これらの代謝は全て水和反応であり、宿主由来の脂肪酸代謝で見られるCYPやLOXなどによる酸化反応とは異なる。代謝物は、共に水酸化脂肪酸であるが、水和反応の場合、二重結合に水分子が付加することによる水酸基の導入であるため、基質の二重結合が一つ減少する。一方、LOXに代表される酸化反応は酸素分子を付加する反応であり、二重結合の数に変化がなく、さらに酸素分子の導入により二重結合が移動し炭素-炭素間二重結合が共役構造を成すように構造が変化するため化合物として不安定であることが多い。よって、代謝物は共に水酸化脂肪酸であるが、腸内細菌の還元的代謝により得られる水酸化脂肪酸と、宿主の酸化代謝により得られる水酸化脂肪酸は似て非なるものである。
1.2飽和化代謝 腸内細菌であるClostridium bifermentansが、リノール酸(cis-9,cis-12-18:2)を共役リノール酸(CLA; cis-9,trans-11-18:2およびtrans-9,trans-11-18:2)を経て、部分的に飽和化されたtrans-11-18:1へ、また同様にEPA (cis-5,cis-8,cis-11,cis-14,cis-17-20:5)を共役EPA(cis-5,cis-8,cis-11,trans-13,cis-17-20:5およびcis-5,cis-8,trans-11,trans-13,cis-17-20:5)を経て、部分的に飽和化されたcis-5,cis-8,trans-13,cis-17-20:4へ代謝することを見いだした(図2)。基質特異性や代謝物を詳細に解析することにより、本代謝では、メチル基末端から数えて6番目と9番目の炭素-炭素結合(ω6位ならびにω9位)にcis型二重結合を有する遊離型の不飽和脂肪酸が基質として認識され、それぞれ対応するω7,ω9共役脂肪酸を経て、ω7不飽和脂肪酸へと部分的に飽和化されることを明らかにした(図2)2)。
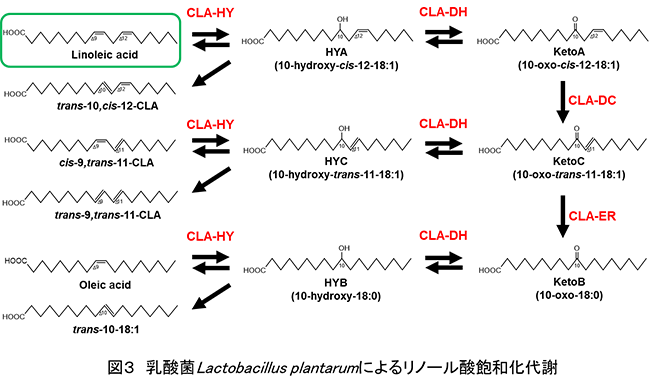
さらに小腸に存在が確認されている腸内細菌の一種である乳酸菌Lactobacillus plantarumが、上記のClostridium bifermentansとは異なる代謝経路でリノール酸を飽和化することを見いだした。本代謝は、4つの不飽和脂肪酸変換酵素(水和脱水酵素(CLA-HY)、酸化還元酵素(CLA-DH)、異性化酵素(CLA-DC)、エノン還元酵素(CLA-ER))が関与しており、以下の通り進行する。リノール酸は、Δ9位の二重結合が水和脱水酵素(CLA-HY)の機能により水和され水酸化脂肪酸10-hydroxy-cis-12-18:1 (HYA)へ変換される。HYAは、酸化還元酵素(CLA-DH)の機能により水酸基がカルボニル基となりオキソ脂肪酸10-oxo-cis-12-18:1 (KetoA)へ変換される。KetoAは、異性化酵素(CLA-DC)の機能によりΔ12位のcis型二重結合がΔ11位のtrans型二重結合へと異性化されエノン型オキソ脂肪酸10-oxo-trans-11-18:1 (KetoC)へ変換される。KetoCは、エノン還元酵素(CLA-ER)の機能によりΔ11位のtrans型二重結合が飽和化され10-oxo-18:0 (KetoB)へ変換される。KetoBは、酸化還元酵素(CLA-DH)の機能によりカルボニル基が水酸基となり、10-hydroxy-18:0 (HYB)へ変換される。最後にHYBは、水和脱水酵素(CLA-HY)の機能により脱水されcis-9-18:1およびtrans-10-18:1へと変換される。以上6ステップの反応を経て二重結合が飽和化される(図3)。また、本代謝には、分岐経路が2つあり、1つはHYAが、水和脱水酵素(CLA-HY)の機能により脱水され共役構造を有するtrans-10,cis-12-18:2へ変換されるものであり、もう一つはKetoCが、酸化還元酵素(CLA-DH)の機能によるカルボニル基の水酸基への変換を経て10-hydroxy-trans-11-18:1 (HYC)となり、HYCが、水和脱水酵素(CLA-HY)の機能による脱水反応を経て共役構造を有するcis-9,trans-11-18:2およびtrans-9,trans-11-18:2へ変換されるものである(図3)3)。本代謝の初発反応を触媒する水和脱水酵素(CLA-HY)の基質特異性は上述したFA-HY2と同様であり、炭素数18でΔ9位にcis型二重結合を有する遊離型の不飽和脂肪酸(オレイン酸、リノール酸、α-リノレン酸、 γ-リノレン酸、ステアリドン酸など)のΔ9位の二重結合を認識しC10位に水酸基を導入することを明らかにしている4)。また、これらの不飽和脂肪酸が、図3と同様の代謝経路を辿ることも明らかにしている。
2.乳酸菌由来不飽和脂肪酸代謝物の生理機能不飽和脂肪酸の乳酸菌代謝物が宿主に与える影響について様々な角度から検討がなされ、多様な生理機能が見いだされている。例えば上皮組織のバリア機能に関しては、腸管、口腔内での作用が認められている。デキストラン硫酸ナトリウム(DSS)誘導腸炎モデルマウスにリノール酸の初期代謝物である水酸化脂肪酸HYA(10-hydroxy-cis-12-18:1)を経口投与すると、HYAが腸管上皮細胞に発現している長鎖脂肪酸受容体GPR40を介して炎症性サイトカインの産生を抑制し、腸管上皮バリア機能の回復により炎症が抑制され、腸炎の症状が緩和されると報告された5)。また、歯周炎モデルマウスを用いた実験で、HYAの摂取が炎症性サイトカインの発現抑制と歯槽骨吸収抑制を介して、歯周病原因菌Porphyromonas gingivalisによって引き起こされる歯肉上皮バリア機能障害を改善することが報告された6)。抗菌活性に関しては、HYAが長鎖プレニル鎖を持つメナキノン産生細菌(ヘリコバクターやカンピロバクターなど)に対して特異的な抗菌作用を有することが見いだされた。ピロリ菌(Helicobacter pylori SS1株及びTN2GF4株)感染マウスにHYAを経口投与すると胃内のピロリ菌数を低下させ、さらにハイルマニイ菌(Helicobacter suis TKY株)感染胃MALT(Mucosa Associated Lymphoid Tissue)リンパ腫モデルマウスにHYAを経口投与すると、胃MALTリンパ腫の発症を抑制することが報告された7)。代謝に関する作用としては、高脂肪食負荷肥満モデルマウスにHYAを投与すると、肥満の症状及びインスリン抵抗性が改善することが見いだされた8)。また、HYAの代謝物であるKetoA(10-oxo-cis-12-18:1)には、カプサイシン受容体(TRPV1)の活性化作用及び、TRPV1を介したエネルギー消費亢進作用が報告されている9)。ここでは主にリノール酸の初期代謝産物HYAに関連する生理機能について例をあげたが、他の代謝物についても様々な生理機能が報告されている。これらの結果は、乳酸菌などの腸内細菌によって代謝され生じた脂肪酸代謝物が、宿主の健康に寄与する可能性を示唆している。 3.おわりに本文では、食事より摂取される脂肪酸の腸内細菌による代謝についていくつか紹介した。食事由来脂肪酸の腸内細菌由来代謝物は、水酸化脂肪酸やオキソ脂肪酸、共役脂肪酸、部分飽和脂肪酸(非メチレン型不飽和脂肪酸)など様々あり、宿主の酸化代謝により得られる代謝物とは異なる。我々が摂取する油脂の中で分布が多いω6脂肪酸であるリノール酸の腸内細菌代謝物の生理機能について主に紹介した。ω3脂肪酸とは対照的な炎症惹起などの生理機能を有すると考えられてきたω6脂肪酸についても、その腸内細菌代謝物がω3脂肪酸に類似する健康増進作用を示すことが明らかになりつつある。 今後、宿主由来代謝物のみならず、より広範な腸内細菌代謝物の生理機能が解明されることにより、食事由来脂肪酸の新たな生理機能や、生理機能発現の実像が明らかになることが期待される。 最後に、本研究に携わってくださった多くの共同研究の先生方、研究室の学生・職員の皆様に厚くお礼申し上げます。 参考文献
略歴
学歴: 2000年3月 京都大学農学部生物機能科学科卒業 2002年3月 京都大学大学院農学研究科応用生命科学専攻修士課程修了 2005年3月 京都大学大学院農学研究科応用生命科学専攻博士後期課程修了、博士(農学)
職歴: 2002年4月 独立行政法人日本学術振興会特別研究員(DC1) 2005年4月 京都大学大学院農学研究科産官学連携研究員 2006年4月 京都大学大学院農学研究科産業微生物学講座寄附講座助手 2007年4月 同上助教 2009年4月 同上特定助教 2011年10月 京都大学大学院農学研究科助教 2018年8月 京都大学大学院農学研究科准教授
受賞歴: 2004年 The American Oil Chemists’ Society 「Honored Student Award」 2004年 AOCS「Biotechnology Division Student Excellence Award」 2010年 日本油化学会「ヤングフェロー賞(JOCS Young Fellow’s Award)」 2011年 日本農芸化学会2011年度大会「トピックス賞」 2011年 第12回酵素応用シンポジウム研究奨励賞 2011年 7th ISBAB「The Best Poster Presentation Award」 2012年 日本農芸化学会2012年度大会「トピックス賞」 2013年 長瀬研究振興賞 2014年 2014年度発酵と代謝研究奨励賞 2015年 第14回オレオサイエンス賞 2015年 酵素工学奨励賞 2015年 平成27年度(第14回)日本農学進歩賞 2016年 平成28年度 農芸化学奨励賞 2017年 2017年度日本農芸化学会関西支部 支部技術賞 2018年 バイオインダストリー奨励賞受賞 2020年 第19回オレオサイエンス賞 サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |