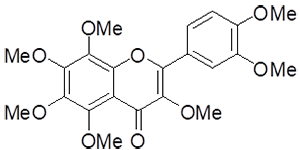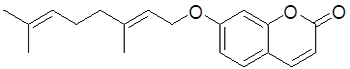|
愛媛県特産柑橘「河内晩柑」果皮の中枢神経系活性化作用
松山大学 薬学部 薬理学研究室
奥山 聡 1. はじめに平成29年産柑橘類の収穫量において、愛媛県は温州みかんに中晩柑類を加えた柑橘類全体では20.7万トンで日本一であり、さらに柑橘類の品目数でみても日本一の数を誇っている。柑橘類には、がん抑制作用や脂質代謝改善作用など、様々な機能を持つ生理活性成分が数多く含まれているが、中枢神経系に作用する柑橘類や成分についての報告はあまり多くなかった。柑橘果皮には脂溶性で低分子の成分が多く含まれており、これらの成分は血液脳関門を通過し脳内で作用する可能性も高いことから、これまでに我々は、柑橘果皮および果皮含有成分の中枢神経系に対する作用について探索および検討を行ってきた。愛媛県産柑橘8種類の果皮を用いて各エタノール抽出エキスを作製、それらをサンプルとし、初代培養神経細胞を用いてMAPキナーゼの一つであるextracellular signal-regulated kinase 1/2(ERK 1/2)のリン酸化を活性化の指標にスクリーニングを行った結果、温州みかんなどと比較して、愛媛県南部の特産品であり文旦類の一種である「河内晩柑」(Citrus kawachiensis; 図1)に強い活性が認められた(1)。河内晩柑の果皮に含まれる成分を分析したところ、ポリメトキシフラボンの一種である3,5,6,7,8,3',4'-heptamethoxyflavone(HMF; 図2)やクマリン化合物の一つであるauraptene(AUR; 図3)が他の柑橘類と比べて多く含まれている特徴があり(2)、これらの成分がERK1/2の活性化作用を有していることも明らかにしてきた(1,3)。しかしこれら各成分の中枢神経系における作用は詳しく調べられていなかったことから、HMF、AURおよび河内晩柑果皮の脳機能に対する作用についてin vivoにおける解析を行ってきた。
図1 河内晩柑
図2 ヘプタメトキシフラボン(HMF)
図3 オーラプテン(AUR)
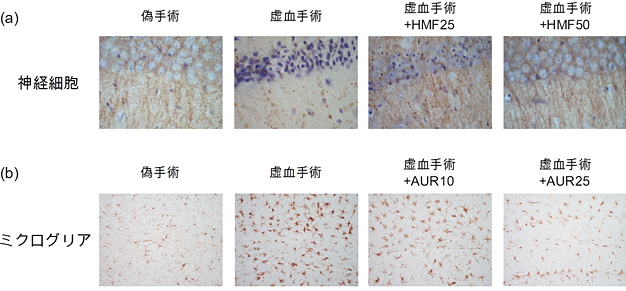
2. 一過性全脳虚血モデルマウスに対するHMF、AURおよび河内晩柑果皮の作用脳血管障害は、寝たきりになる原因が最も高い疾患として知られている。脳虚血病態では脳血流量の減少、グルタミン酸毒性、酸化ストレス、過剰な炎症反応など様々なメカニズムにより、記憶に重要な脳領域である海馬などで神経細胞死が誘導される。近交系C57BL/6マウス(雄、9週齢)に対して、両側総頚動脈流を12分間クリップで一時的に止め、その後再灌流する手術で一過性全脳虚血モデルを作製し、手術後HMF(25 mg/kg/dayもしくは50 mg/kg/day)を浸透圧ポンプに充填したものを各マウスの皮下に埋め込み、3日間の徐放性連続投与を行った。その後解剖により脳を摘出し、組織染色による評価を行ったところ、海馬において、虚血群では免疫担当細胞であるミクログリア(Iba1陽性細胞)が増加し、CA1領域における神経細胞死が認められたが(図4-a)、HMFの投与によりそれらが有意に抑制されていた。またHMFの投与によって、神経細胞に対する栄養分子として知られている脳由来神経栄養因子(BDNF)の発現が増加し、神経新生(神経幹細胞や前駆細胞から新たな神経細胞が分化する現象)も促進されていた(4)。AUR(10 mg/kg/dayもしくは25 mg/kg/day)も同様に浸透圧ポンプに充填し、脳虚血手術5日前に投与を開始して、脳虚血手術3日後の脳内を解析したところ、海馬におけるミクログリアの活性化(図4-b)と神経細胞死がAURの投与によっても有意に抑制されていた(5)。HMFとAURは脂溶性が高い化合物であることから、脳に移行するか検討したところ、腹腔内に投与したHMFとAURが脳組織から検出されたことから、両化合物は血液脳関門を通過し脳内に移行することが示唆された(5,6)。 次に、河内晩柑果皮粉末(1.2 g/kg/dayもしくは2.4 g/kg/day)を1日1回経口投与し、投与5日目に同様の一過性全脳虚血手術を行い、その3日後に脳組織を解析したところ、海馬におけるミクログリアの活性化およびCA1領域の神経細胞死は、河内晩柑果皮粉末投与によっても有意に抑制されていた(7)。
図4 一過性全脳虚血モデルマウスに対するHMFおよびAURの作用 (a)海馬CA1領域における神経細胞と樹状突起 (b)海馬放線層・網状分子層におけるミクログリア
3. 2型糖尿病モデルdb/dbマウスに対する河内晩柑果皮の作用糖尿病の人はそうでない人に比べて、アルツハイマー病の発症が2.18 倍、また血管性認知症は2.77 倍おこりやすいことが報告されている。db/dbマウスは、ヒトの肥満型糖尿病に類似した症状を発現する2型(インスリン非依存型)糖尿病モデル動物で、過食・肥満を呈する。db/dbマウスに、河内晩柑果皮粉末(0.5%もしくは1%)を添加した飼料を24週齢まで自由摂食させる実験を行ったところ、対照群のマウスに対し、db/dbマウスでは有意な血糖値上昇がみられたが河内晩柑果皮投与による血糖降下作用は認められなかった。しかしながら、db/dbマウスでみられた海馬におけるアストロサイトの活性化、神経細胞に存在するタウタンパクの過剰なリン酸化および神経新生の抑制が、いずれも河内晩柑果皮投与によって改善されていた(8)。 4. 老化促進モデルマウスSAMP8に対する河内晩柑果皮の作用老化促進モデルマウスSAMP8は、老化促進・短寿命に加えて学習・記憶障害を特徴とするマウスである。5ヶ月齢のSAMP8マウスに対して、河内晩柑果皮粉末1%を添加した飼料を9ヶ月齢まで自由摂食させる実験を行い、8ヶ月齢時に嫌悪記憶を基にした記憶・学習試験としてStep-through passive avoidance testを実施した。Passive avoidance testでは、明室と暗室に分かれた部屋の明室にマウスを入れ両部屋の仕切りを開けると、マウスの習性で暗室に移動する。暗室では足元から弱い電気刺激を受けるため、この状況を記憶すると明室から暗室に移動することを避けることから、明室に留まる時間を記憶の指標として計測した。初日の獲得試行のトレーニングでは対照マウスSAMR1と、通常食を与えたSAMP8マウスまたは果皮添加食を与えたSAMP8マウス間で大きな差はみられなかったことから、記憶の獲得には差がないことが示唆されたが、次の日に実施した保持試行(暗室との仕切りを開けた状態で、明室に留まっている時間の計測)では、SAMP8マウスは対照マウスSAMR1に対して有意に短い保持時間だったのに対し、果皮投与群では記憶保持が延長される傾向にあった。それは2日後に実施した同試行でも同様であったことから、河内晩柑の果皮には記憶保持力を延長させる効果があることが示唆された。海馬CA3領域は多くのシナプスが形成され記憶・学習のメカニズムに重要な部位であることから、シナプス小胞タンパク質であるsynaptophysinで染色したところ、SAMP8マウスでは有意なシグナル量の低下がみられたが果皮投与によって抑制されていた。その他にも、SAMP8マウスで認められた海馬におけるミクログリアの活性化およびリン酸化タウタンパクの増加、さらには神経新生の低下も果皮の投与によって改善されていた(9)。 5. おわりに以上の結果から、AURは脳内における抗炎症作用、またHMFには抗炎症作用とBDNF産生および神経新生促進を特徴とした作用があり、共に脳保護効果を有することが明らかになった。またこれらの成分のみならず河内晩柑果皮自体にも脳機能に対する様々な作用があることも分かってきた。AURやHMFが、河内晩柑果皮でみられる諸作用の発現に関与している可能性は十分に考えられるが、河内晩柑果皮乾燥粉末1 g中に含まれるAURとHMFの量はそれぞれ4.07 mgと0.27 mgであり(10)、河内晩柑果皮を用いた実験で効果があった際の果皮粉末に含まれるAURとHMFの量は、それぞれの成分を単独投与した際の実験よりもかなり低い投与量で作用していることになることから、河内晩柑果皮の生理活性作用はAURやHMFだけではなく、その他の化合物によっても引き起こされている可能性が考えられる。例えば河内晩柑果皮にはフラバノン類の一種であるnaringin(NGI)も多く含まれていることが分かっており(2)、我々はNGIに関しても全脳虚血および高血糖モデルマウスにおける抗炎症作用や神経細胞保護作用について明らかにしている(7,11)。このように河内晩柑果皮は機能性生理活性成分を多く含み、脳機能障害の予防や改善などにも寄与できる素材としての可能性が示されている。 柑橘類は国内で生産される主要な果実であるが、その生産および消費は減少している。柑橘類に新規の生理活性作用と新たな付加価値を見出すことは、地域における農産振興および地域産業の活性化、そして高ストレス社会および高齢社会である現代における健康維持や疾病予防に向けた取り組みなどの面でも、大きく貢献できるものと期待している。 参考文献
略歴1999年東京薬科大学薬学部卒業 2004年静岡県立大学大学院生活健康科学研究科博士課程(食品栄養科学専攻)修了 カナダUniversity of Saskatchewan博士研究員、アメリカUniversity of Nebraska Medical Center博士研究員を経て、2009年より松山大学薬学部薬理学研究室助教。2017年より同准教授。 現在は、中枢神経系に作用する天然物・食品成分の探索と機能発現機構の薬理学解析に関する研究に従事。 サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |