|
捨てたものじゃないわさびの葉 〜成分と機能性〜
東洋大学 食環境科学部 健康栄養学科
准教授 細谷 孝博 1. はじめに「わさび」と言えば、寿司やそばなどの日本料理で使われるあの鼻にツーンと抜ける薬味を思い浮かべるだろう。これから概説する内容は、「すりおろしたわさび」ではなく、その葉についてである。わさびの栽培では、根茎(いも)が目的であり、収穫後の葉は捨てられてしまうことが多い。こうした本来ならば捨てられてしまう資源の有効利用を目指し、わさびの葉の有用性を、成分と機能性の面から概説する。 1-1. わさびについてわさびは、学名をEutrema japonicum(以前は、Wasabia japonica Matsum.)といい、アブラナ科(Brassicaceae)ワサビ属に属する日本原産の多年生植物である。通常、根茎をすりおろし、様々な日本料理で薬味として使われている。あの鼻にツーンと抜ける成分は、アリルからし油(allylisothiocyanate)を中心とした揮発性成分である。アリルイソチオシアネートなどの揮発性成分は、それ自身として元々わさびに存在しているのではなく、わさびの細胞中に含まれるシニグリン配糖体が、すりおろされる段階でミロシナーゼによって加水分解されることで生成する。生成したアリルイソチオシアネートは、炭素鎖や置換基の違いにより多数の誘導体が知られているが、その中でも、6-methylsulfinylhexyl isothiocyanate(MS-ITC)は、抗菌、抗ピロリ、抗血小板凝集、抗変異原作用などの多種多様な生理活性を有するとの研究報告がある1),2)。こうした成分は、葉にも含まれるが、根茎に多いこと、また多種多様な生理活性を有することから、わさびの研究は根茎が中心である。現在、こうした機能性を生かした抗菌グッズなどの商品開発も進んでいる。 1-2. わさびの葉の利用以前、伊豆にある旅館で食事をしたとき、わさびの葉を皿代わりにしたり、料理の上に被せ、蓋代わりにしたりしていた。店の方に、「このわさびの葉はどうすればいいですか?」と伺うと、「退けて料理をお楽しみください」とのことだった。料理に被さっていたわさびの葉は、ハート型の掌サイズで、緑が濃くみずみずしい葉だった。店の方に隠れて、わさびの葉をかじると、根茎をすりおろしたときと同様の鼻にツーンと抜ける風味はしたが、根茎ほどではなかった。一般的に、わさびの葉は、若くやわらかい葉で虫食いなどがないものを料理の素材として使うことがあるが、その用途は限られている。 1-3. わさびの葉の廃棄わさびの栽培の目的は根茎であり、収穫後、葉や茎は捨てられてしまうことが多い。また、根茎の収穫時には、葉は虫に食われてしまうこともあり、先に述べた料理への応用も難しい。しかし、Kinae等により、わさびの機能性を見直す研究が行われ、わさびのそれぞれの部位(根茎、茎および葉)の抗酸化、ラジカル捕捉、抗菌、抗カビ、抗変異源、抗発がん作用などが報告された3)。この報告には、わさびの葉にも様々な機能性を有することが示されていたが、その機能性を示す成分までは報告されていなかった。そこで、わさびの葉の有用性を科学的に立証するため、その機能性を成分レベルから明らかにすることとした。以下、筆者がこれまでに行ったわさびの葉の研究について説明する。
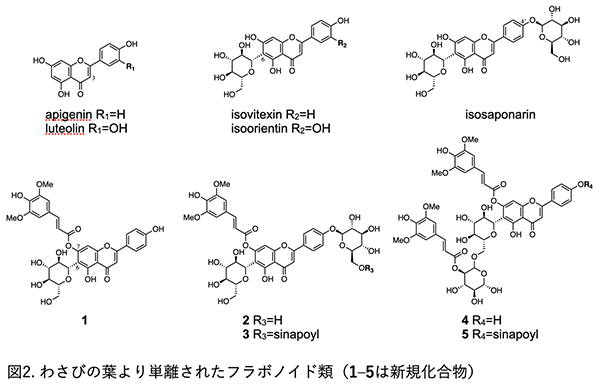
2. わさびの葉の成分わさびの葉を乾燥後、メタノールを用いて成分を抽出し、得られたメタノール抽出物について、ヘキサン、酢酸エチル、n-ブタノールで順次分配し、それぞれの抽出物を得た。それぞれの抽出物について、各種クロマトグラフィー(シリカゲル、ODS、Sephadex LH-20、Diaion HP-20など)を用いて成分を分離し、最終的に高速液体クロマトグラフィー(HPLC)による精製を行った。得られた単一化合物は、各種分析機器(核磁気共鳴(NMR)、質量分析(MS)、紫外吸収スペクトル(UV)等)により、その化学構造を決定した。それぞれの抽出物から、フラボノイド類およびフェニルプロパノイド類を主要成分として単離した。以下、新規化合物を含むフラボノイド類およびフェニルプロパノイド類について述べる。 2-1. フラボノイド類フラボノイドは、植物に広く分布し、色素として知られるものが多い。その骨格は、C6-C3-C6化合物であり、その骨格や結合する置換基により、名称が変わる。わさびの葉より得られたフラボノイド類は、3位に水酸基をもたないフラボン骨格である。特に、apigeninの6位にβ-D-glucoseが炭素-炭素結合(C-C:グリコシド結合(-O-)ではない)したisovitexinを多く含んでいた。この化合物を基本に、4’位にβ-D-glucoseがグリコシド結合したisosaponarin、また、これら化合物の糖やアグリコンに、シナピン酸(sinapoyl基)がアシル結合した化合物が単離され、これら化合物は新規化合物であった(図2)4)。これら新規化合物は、NMRやMS等の各種スペクトルデータに基づき化学構造の決定を試みたが、7位のシナピン酸の結合を証明することが困難だった。例えば、NMRによる解析(水素-炭素の相関がわかるHMBCや水素の空間的な相関がわかるNOESY)では、アグリコンとシナピン酸の相関を得ることができなかった。そこで、糖やsinapoyl基を酵素や試薬で加水分解した後、既知化合物の各種スペクトルデータと比較することで、その結合部位を明らかにした(詳細は論文を参照4))。このような結合様式のフラボン類の報告は非常に少なく、わさびの葉の成分の特徴と言える。 その他、apigenin、luteolin、isovitexin、isoorientin、isosaponarinなども既知化合物として単離した(図2)。
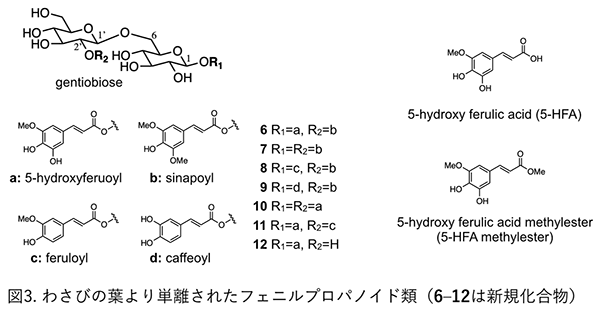
2-2. フェニルプロパノイド類フェニルプロパノイドとは、芳香環に直鎖状3炭素が結合した天然物で、C6-C3化合物の総称である。わさびの葉からは、2分子のβ-D-glucoseが、C6–C1’結合したgentiobioseに、フェニルプロパノイドがアシル結合した化合物が単離された5)。これら化合物は、新規化合物であり、わさびの葉に含まれる成分の特徴と言える(図3)。また、フェニルプロパノイドの中でも、ferulic acidの5位に水酸基が結合した5-hydroxyferulic acid(5-HFA)、またそのメチルエステル体(5-hydroxyferulic acid methylester: 5-HFA methylester)が多く含まれており、これら化合物の報告は、わさびの葉が初めてであった。5-HFAは、gentiobioseに結合した配糖体としても多く存在しており、5-HFAがわさびの葉の特徴的な成分であると言える。 その他、p-hydroxycinnamic acid、ferulic acid、sinapic acid、ferulic acid methylester、sinapic acid methylesterなども既知化合物として単離した。
2-3. その他その他成分として、カロテノイドの一種であるall-trans-lutein、テルペノイドのdehydrovomifoliolやcis-roseosideも単離した6)。 3. わさびの葉の抗酸化活性わさびの葉より単離した化合物(フラボノイド類およびフェニルプロパノイド類)について、電子スピン共鳴(Electron Spin Resonance: ESR)によるスーパーオキシドアニオンラジカル(O2−)消去活性を測定した。フラボノイド類のラジカル消去活性は、高濃度では活性が見られたものの、消去活性が高いものはなかった。一方、フェノルプロパノイド類では、芳香環部に、o-dihydroxy構造を有している化合物に高いラジカル消去活性が見られ、また、それら配糖体となることで、さらに活性が強まることが分かった(表1)5)。例えば、5-HFAや5-HFA methylesterのIC50(50%阻害濃度)は、30 μM程度であるが、5-HFAがgentiobioseに2分子結合した化合物10のそれは、8.4 μMであった。わさびの葉には、5-HFAの構造を有する化合物がカルボン酸メチルエステル体や配糖体として存在していること、また、これら化合物はわさびの葉に特有に含有することから、わさびの葉の抗酸化成分としての役割は大きいと考える。
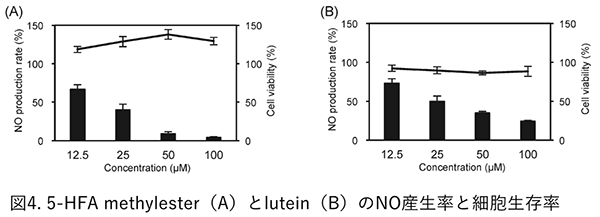
4. わさびの葉の抗炎症活性わさびの葉のメタノール抽出物について、マウスマクロファージ由来培養細胞(J774.1)を用いた抗炎症活性を評価したところ、活性を示した。本評価系は、マクロファージで発現する誘導型NO合成酵素(iNOS: inducible nitric oxide synthase)をリポ多糖(LPS: lipopolysaccharide)による刺激で亢進させると、NOが過剰合成される。このNOの量を間接的に測定することで、NO産生率(抗炎症作用)を評価することができる。 活性を指標とした成分の分離を行った結果、わさびの葉に含まれるNO合成を抑制する成分は、5-HFA methylesterおよびluteinであった。これら化合物は、細胞の生存率に影響を与えず、本評価法において、NO産生率を濃度依存的に下げた(図4)。また、両化合物は、LPS刺激によるiNOSの発現をmRNAレベルで阻害することも分かった6)。
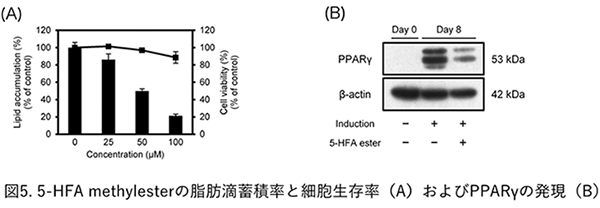
5. わさびの葉の抗肥満活性わさびの葉の抗肥満活性については、これまでに、マウスを用いたin vivoでの検討がされていた。Yamasaki等は、わさびの葉の熱湯抽出物の体重減少とその作用機序について報告している7)。また、Oowatari等は、わさびの葉の抽出物が、PPARγとAMAPを介して、脂肪細胞肥大を抑制することを報告している8)。しかし、これらの活性成分の解明には至っておらず、我々はわさびの葉に含まれる成分を単離し、マウス前駆脂肪細胞(3T3-L1)を用いたin vitro実験を行った。 わさびの葉に含まれる成分について、3T3-L1細胞を用いた分化抑制活性を評価したところ、5-HFA methylesterに活性を示すことが分かった。先に述べた抗酸化および抗炎症活性でも、本化合物には活性が見られており、抗肥満活性でも同様の結果となった。本化合物について、その作用機序を調べたところ、PPARγタンパク量の発現を抑制することが分かった(図5)。また、脂肪細胞分化のマスターレギュレーターであるPPARγとC/EBPαのmRNA発現量も有意に減少した。それに伴い、ターゲット遺伝子であるGLUT4、LPL、SREBP-1c、ACCおよびFASのmRNA発現量も有意に減少することも確認した9)。 また、フェニルプロパノイド類(trans-cinnamic acid骨格)について、構造活性相関に関する研究も行った。フェニルプロパノイドの芳香環部分の置換基およびカルボン酸部分(メチルエステル)について、種々化合物を合成し、3T3-L1細胞を用いた抗肥満活性を評価したところ、o-dihydroxy構造にメトキシ基が隣接した構造が重要であり、なおかつ、カルボン酸がメチルエステル化されることにより、さらに活性が強くなることが分かった。わさびの葉の抗肥満活性について、in vivoでの評価が行われていたが、その活性本体が、5-HFA類(特に、5-HFA methylester)である可能性が強く示唆された9)。
6. 終わりにここまでわさびの葉の成分および機能性ついて述べてきたが、成分の面からは、7位にsinapoyl基を有するフラボン配糖体、また、5-hydroxyferulic acidの構造を有するフェニルプロパノイド類など、わさびの葉に特徴的な成分が含まれていることが分かった。また、5-HFAの構造を有する化合物は、抗酸化、抗炎症、抗肥満活性のいずれにも関わっていることが分かり、わさびの葉に含まれる特有の機能性成分であることが示唆される。ただし、この5-HFAの構造を有する化合物は、わさびの葉には、配糖体として含まれていることが多く、配糖体としては活性を示さない場合もある。こうした機能性成分を我々が摂取する際、いかに活性に適した形にするかなどの研究を進めていきたいと思う。また、他の機能性も期待されることから、さらなるスクリーニングを行うことで、わさびの葉の機能性を増やしていきたいと思う。 本来ならば捨てられてしまうわさびの葉だが、このようにヒトの健康に寄与できる成分を含んでいることが示された。また、最近ではわさびの花に関する研究も報告した10)。今後、わさびの葉が捨てられず、我々の健康に貢献し得る素材として、見直されることを期待する。 参考文献
略歴東京薬科大学生命科学部卒業、東京薬科大学大学院生命科学研究科博士前期課程修了、千葉大学大学院医学薬学府博士後期課程修了(博士(薬学))。 星薬科大学薬学部助教、バイオ産業情報化コンソーシアム特別研究職員、静岡県立大学食品栄養科学部助教、横浜薬科大学薬学部講師を経て、2018年より東洋大学食環境科学部准教授(現在に至る)。 サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |