|
褐色脂肪組織機能と食品成分による機能制御
京都大学大学院農学研究科
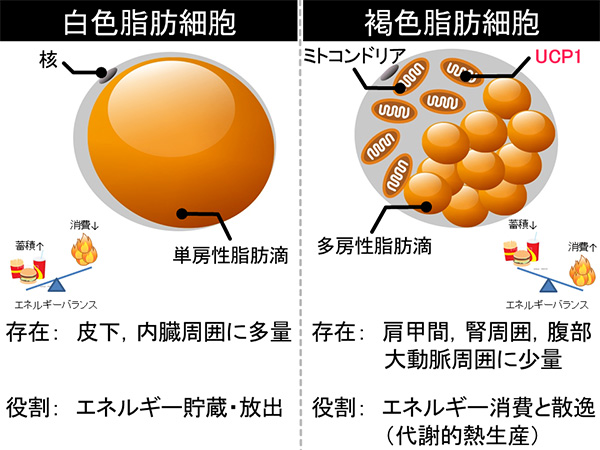
准教授 後藤 剛 1. はじめに過栄養・運動不足を背景とした肥満者の増加が世界的な健康問題となっている。肥満の進展は動脈硬化性疾患の発症リスクと正の相関があり、高血圧や糖・脂質代謝異常と合併することで動脈硬化性疾患のリスクが飛躍的に増加することから、メタボリックシンドロームの発症基盤と位置づけられている。肥満の進展は日々の食事内容との関連性が深く、多くの場合慢性的に進行するため、食品中に含まれる機能性成分の活用は肥満進展の予防にとって有用な方策の一つとなり得るものと考えられる。肥満は摂取エネルギーが消費エネルギーを上回った状態が継続することで惹起されるため、高いエネルギー消費能を有する褐色脂肪組織は肥満の予防・改善の有力な標的組織であると言える。近年の研究によって、特定の食品成分の摂取が褐色脂肪組織機能を亢進させる作用を有することが明らかになりつつある。本稿では、褐色脂肪組織機能について概説し、食品成分による褐色脂肪組織活性化に関する知見について、私達の研究結果を中心に概説したい。 2. 脂肪組織について ~褐色脂肪組織を中心に~肥満は脂肪組織が過剰に蓄積した状態と定義されているが、脂肪組織は白色脂肪組織と褐色脂肪組織に大別され、肥満時に過剰蓄積されるのは白色脂肪組織である(図1)。脂肪組織は主に中性脂肪を蓄積した脂肪滴を有する脂肪細胞によって構成されている。白色脂肪組織を構成する白色脂肪細胞は、単房性の脂肪滴を有する白色脂肪細胞で主に構成されており、余剰エネルギーを中性脂肪として脂肪滴に蓄積し、必要に応じてグリセロールと遊離脂肪酸に分解してエネルギー源として全身に再供給する機能を有する。したがって、エネルギー供給量がエネルギー消費量を慢性的に上回る肥満状態では、白色脂肪細胞に蓄積される脂肪滴は肥大化し、直径が100 μmを超えるような白色脂肪細胞も認められる。成人の脂肪組織は大部分が白色脂肪組織であり、褐色脂肪組織は局所的に限られた量が存在している。両脂肪組織はレプチンやアディポネクチンに代表される、「アディポカイン」と総称される様々な生理活性物質の分泌機能を有しており、アディポカインの分泌を介して生体の代謝恒常性維持に寄与することが知られている。特に、肥満時に蓄積量が増加する白色脂肪組織から分泌されるアディポカインは肥満に伴う代謝異常症の発症に深く関与していると考えられており、また白色脂肪組織由来のアディポサイトカイン分泌制御機能を有する食品由来成分についての研究も進展していることから、将来的な応用が期待される [1, 2]。
図1.白色脂肪細胞と褐色脂肪細胞の比較
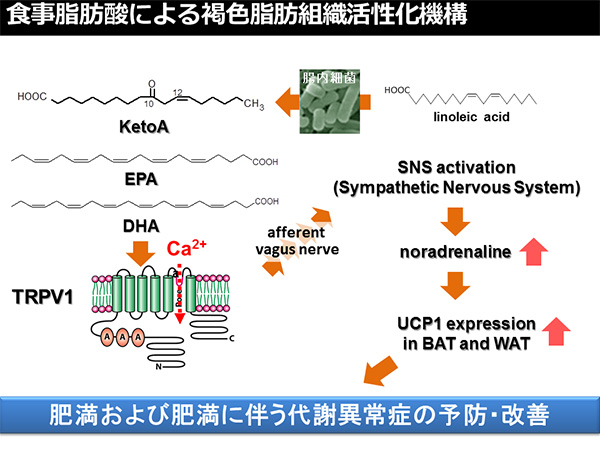
褐色脂肪組織は多房性で小型の脂肪滴を有するという形態学的な特徴を有する褐色脂肪細胞より主に構成されており、高い熱産生能を有する組織である。褐色脂肪細胞の有する多房性の脂肪滴の周囲には多数のミトコンドリアが存在し、ミトコンドリアに存在するタンパク質、シトクロムによって褐色を帯びている。褐色脂肪組織では毛細血管がよく発達しており、褐色脂肪組織が呈する特徴的な色相に寄与するとともに、褐色脂肪組織で発生した熱を血流により速やかに全身に伝えている。さらに、褐色脂肪組織には交感神経が豊富に分布しており、寒冷刺激などによって活性化され、褐色脂肪組織の熱産生調節において極めて重要な役割を担っている。褐色脂肪組織の高い熱産生能は褐色脂肪細胞のミトコンドリア内膜上に存在する、脱共役タンパク質1(UCP1) の機能による。UCP1はミトコンドリアでの酸化的リン酸化(アデノシン三リン酸 (ATP) 合成)を脱共役させる機能を有するタンパク質である。すなわち、通常ミトコンドリアの電子伝達系によって形成されるミトコンドリア内膜内外のプロトン濃度勾配はATP合成に利用されるが、UCP1はATP合成を伴うことなく、プロトン濃度勾配を解消する特殊なチャネル活性を有しており、プロトン濃度勾配による化学エネルギーがATPに留めおかれることなく、熱として散逸消費されるのである [3]。 褐色脂肪組織の主要な生理的役割は、寒冷化での体温維持にある。ヒトの場合、新生児において褐色脂肪組織が豊富に存在しており(体重の数パーセントを占める)、出生時の急激な寒冷曝露に際して体温の低下を防ぐ役割を担っている。他方、成長に伴い、褐色脂肪細胞が消失するため、成人では褐色脂肪組織量が白色脂肪組織に比して圧倒的に少なく、近年に至るまで成人における機能的な褐色脂肪組織の存在は疑問視されていた [3]。しかしながら、核医学領域の画像診断法の1つである、2-fluoro-2-deoxyglucose (FDG) を用いた positron emission tomography-computed tomography (PET-CT) により代謝機能面からヒト褐色脂肪組織を検出・評価できることが明らかにされた2009年以降、成人における機能的な褐色脂肪組織の存在が明らかにされ、様々な検討がなされてきている [4]。特に、褐色脂肪組織機能(脂肪細胞による高い熱産生機能)の活性が肥満度と逆相関することが明らかにされたことから、褐色脂肪組織機能は肥満や肥満に伴う代謝異常症に対する新たな予防・治療標的組織として注目されている。 また、近年の精力的な褐色脂肪組織機能に関する研究の結果、寒冷刺激のような特定の刺激条件下において、白色脂肪組織内に褐色脂肪細胞様の性質(多房性の脂肪滴およびUCP1を有し、高い熱産生機能をもつ)を有する、第3の脂肪細胞、「ベージュ脂肪細胞」が発生することも明らかになってきた(この現象は白色脂肪組織の「褐色化」と呼ばれている)。成人の褐色脂肪組織機能の大部分を担っているのは古典的な褐色脂肪細胞ではなく、ベージュ脂肪細胞であることが示唆されており、肥満症への応用に向けてベージュ脂肪細胞の誘導機構および誘導因子の解明が期待されている [3]。 上述の通り、褐色脂肪細胞およびベージュ脂肪細胞が担う褐色脂肪組織機能(代謝的熱産生)活性化の誘導因子として最もよく知られるものは寒冷刺激である。寒冷刺激に応じて活性化される交感神経末端より放出されたノルアドレナリンが、褐色脂肪細胞・ベージュ脂肪細胞上に存在するβ-アドレナリン受容体に作用すると、UCP1の活性化・発現上昇が惹起され、熱産生が亢進し、寒冷化での体温維持に寄与することが示されている [3]。また、寒冷刺激以外にも運動などの環境刺激に応じて、褐色脂肪組織機能の活性化が誘導されることが報告されている [3]。さらに、褐色脂肪組織機能を活性化する刺激として特定の食品成分が機能することが示されており、その摂取は褐色脂肪組織機能亢進を惹起することで、肥満や肥満に伴う代謝異常症の予防・改善において有用な効果を発揮しうることが明らかになりつつある [5]。そこで以降の部分では、褐色脂肪組織機能制御機能を有する食品成分とその分子機構について代表的なものを紹介したい。 3. TRPチャネル活性化を介した褐色脂肪組織機能活性化作用を有する成分褐色脂肪組織機能活性化作用を有する食品成分として最もよく研究されているものは、トウガラシの辛み成分であるカプサイシンと辛みの少ないトウガラシにおいて見出されたカプサイシン類似化合物(カプシノイド)群である。カプサイシンやカプシノイドの生理作用を仲介する生体内受容体として、Transient Receptor Potential (TRP) チャネルに属するTRPV1 が同定されている。TRP チャネルは膜電位、温度、pH、浸透圧などの物理的刺激やジアシルグリセロール、リン脂質などの内在性化学物質および食品成分に代表される外来性化学物質によってイオン透過性が制御される、非選択的な陽イオンチャネルである。TRP チャネルは大きなスーパーファミリーを形成し、哺乳類では、 TRPC、TRPV、TRPM、TRPML、TRPP、TRPA の 6 種のサブファミリーに分かれている [6]。 カプサイシンやカプシノイドによる褐色脂肪組織機能活性化の分子機構については、実験動物を用いて詳細な検討が行われており、経口摂取したカプサイシンやカプシノイドは消化管においてTRPV1に作用し、求心性迷走神経、交感神経の活性化を惹起し、褐色脂肪組織機能を活性化することが明らかにされている [5, 7]。また、カプシノイドの経口摂取については、ヒト褐色脂肪組織機能活性化に対する有用性も検証・報告されている。FDG-PET-CT検査により褐色脂肪組織が検出された人を対象とした、カプシノイドの単回投与は、摂取開始30分以降エネルギー消費量を有意に増加させたのに対し、褐色脂肪組織非検出者に対するカプシノイド投与時にはエネルギー消費量の有意な増加は認められなかった。摂取後2時間の累積エネルギー消費量に関して、褐色脂肪組織検出・カプシノイド摂取群では、褐色脂肪組織検出・プラセボ摂取群、褐色脂肪組織非検出・カプシノイド摂取群よりも有意に増加した [8]。さらに、カプシノイド長期摂取の褐色脂肪組織誘導・増量効果に関する検証実験において、褐色脂肪組織非検出者においても6週間の継続的なカプシノイド摂取により、褐色脂肪組織の増量、寒冷誘導熱産生の亢進が認められている [9]。これらの結果は、ヒトでもカプシノイドが TRPV1→迷走神経→脳→交感神経→褐色脂肪組織の経路を活性化してエネルギー消費を増やし、体脂肪低減効果を発揮することを示唆している。 我々はマウスを用いた実験において、魚油中に豊富に含まれるn-3系多価不飽和脂肪酸であるエイコサペンタエン酸(EPA)やドコサヘキサエン酸(DHA)がTRPV1の機能を介して褐色脂肪組織機能の亢進を惹起し、抗肥満・抗生活習慣病作用を発揮することを明らかにした [10]。さらに、食事由来不飽和脂肪酸(リノール酸)の腸内細菌代謝産物であるオキソ型脂肪酸(10-oxo-cis-12-octadecenoic acid, KetoA)がTRPV1活性化作用を有し、褐色脂肪組織機能の亢進作用を有することも報告している (図2)[11]。ヒトでの機能検証が不可欠であるが、カプサイシンやカプシノイドに加え、これらのTRPV1活性化作用を有する食品成分についてもその有用性が期待される。 TRPV1以外のTRPチャネルも食品成分によって活性化されることが知られている。TRPM8活性化作用を有するミントに含まれるメントールやTRPA1活性化作用を有する緑茶中のカテキン類、ワサビ中のアリルイソチオシアネート、ニンニク、タマネギ中のアリシンなどの食品成分についてもTRPV1と類似の交感神経活性化を介した褐色脂肪組織機能の活性化が期待されている [5]。特に茶カテキン類については長期的な摂取による体脂肪蓄積抑制効果がヒトにおいてもよく知られているが、最近、カプシノイドと同様に、ヒトにおいても褐色脂肪組織機能の活性化作用を介したエネルギー消費の増加を惹起することが示されている[12]。以上のように、食品成分によるTRPチャネルの活性化は、褐色脂肪組織機能の亢進作用を介した抗肥満の予防において有用な標的となりうるものである。
図2.食事由来脂肪酸によるTRPV1活性化を介した褐色脂肪組織機能の活性化機構 BAT, 褐色脂肪組織、WAT, 白色脂肪組織
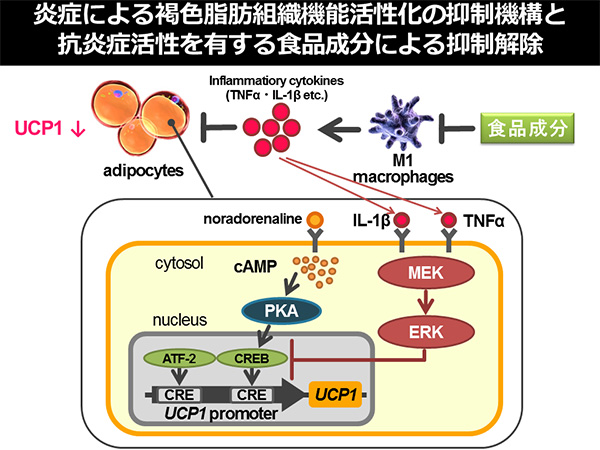
4. 抗炎症活性を介して褐色脂肪組織機能の活性化作用を有する成分肥満状態の脂肪組織ではマクロファージの浸潤・活性化によって慢性炎症状態が惹起されており、肥満に伴う代謝異常症発症の主要因として考えられている [1-3]。我々は、慢性炎症状態下の脂肪組織では炎症性サイトカインの発現亢進に伴い、アドレナリンに対する感受性の低下が惹起され、アドレナリン刺激によって誘導される白色脂肪組織の褐色化が抑制されることを報告してきた(図3)[13-15]。そのため、脂肪組織において慢性炎症状態を緩和させる化合物は、炎症によって惹起される白色脂肪組織褐色化の抑制を解除し、褐色脂肪組織機能亢進作用を有することが期待される(図3)。食品成分中にはポリフェノール類をはじめとする種々の炎症抑制活性を示す物質が存在することが知られており [16]、我々は脂肪組織の慢性炎症に対し、抗炎症活性を有する食品成分の探索を行い、褐色脂肪細胞機能に与える影響について評価した。 アシタバに特徴的に含まれるカルコン類(キサントアンゲロール (XA) および4-ヒドロキシデリシン (4-HD))の抗炎症活性について評価したところ、XA、4-HDともにリポ多糖 (LPS) によって惹起されるマクロファージ様細胞、RAW264.7細胞の炎症性メディエーター産生を強く抑制した。XA、4-HD は、肥満状態の脂肪組織を模倣した肥大化脂肪細胞とマクロファージ様細胞の共培養系においても炎症性メディエーター産生を抑制し、肥大化脂肪細胞由来の培養上清によって惹起されるマクロファージ様細胞の活性化抑制作用も認められた。これらの結果から、XA、4-HD は肥満状態の脂肪組織において惹起される慢性炎症状態に対し、抑制作用が期待される食品成分であることが明らかになった。そこで、XA、4-HDが炎症状態下で抑制された褐色脂肪組織機能を回復しうるか、培養細胞系を用いて検討を行った。培養脂肪細胞に対して、LPS刺激したマクロファージ様細胞の培養上清を添加すると、アドレナリン刺激によって惹起されるUCP1プロモーターの活性化が抑制され、アドレナリン刺激によるUCP1遺伝子発現誘導も抑制された。一方で、XA、4-HD 存在下でLPS刺激したマクロファージ様細胞の培養上清を添加した場合には、減弱したアドレナリン刺激時のUCP1プロモーター活性化、UCP1遺伝子発現誘導の回復が認められた。以上の結果から、XA、4-HDはマクロファージ活性化を抑制することで、脂肪組織の慢性炎症状態を軽減し、アドレナリン刺激による褐色脂肪組織機能活性化の抑制を解除することが示唆された(図3)[17]。最後に、肥満モデルマウスを用いてXAの長期摂取が肥満および肥満に伴う代謝異常症の発症を予防しうるかどうか検討を行った。XA投与は高脂肪食によるマウスの体重増加を抑制し、耐糖能異常などの代謝異常症の発症を緩和させた。白色脂肪組織においては、炎症状態の抑制、UCP1遺伝子発現量の上昇傾向が認められた [17]。以上の結果より、XAのような脂肪組織において炎症抑制効果を示す食品成分は、慢性炎症状態による褐色化の抑制を解除することで、肥満症に対して有用性を発揮しうることが示唆された。 私達の研究グループではXAや4-HDと同様に抗炎症活性を有し、細胞レベルで褐色脂肪組織機能の抑制を解除しうる化合物を複数同定している。これらの化合物には、食事由来不飽和脂肪酸の腸内細菌代謝産物も含まれており、前章で述べたKetoAによる褐色脂肪組織機能活性化機構も含め、腸内細菌による食事脂肪酸代謝産物を介した宿主の褐色脂肪組織機能調節機構が複数存在することが示唆される [18-20]。
図3.炎症による褐色脂肪組織機能活性化の抑制機構と抗炎症活性を有する食品成分による抑制解除 TNF-α, tumor necrosis factor-α; IL-1β, interleukin-1β; cAMP, cyclic AMP; PKA, protein kinase A, CRE, cAMP response element; CREB, CRE-binding protein; ATF-2, activating transcription factor-2; ERK, extracellular signal-regulated kinase; MEK, mitogen-activated protein kinase/ERK kinase.
5. おわりに本稿では、褐色脂肪組織機能および褐色脂肪組織機能の活性を制御しうる食品成分とその作用機構について概説してきた。本稿で紹介した食品成分以外にも、ブドウの種子や皮に含まれるポリフェノールの一種、レスベラトロールのようにSirtuin 1活性調節を介した褐色脂肪組織活性化作用を有する食品成分や、ビタミンAの活性型代謝物であるレチノイン酸のように核内受容体型転写因子活性調節作用を介して褐色脂肪組織活性化作用を有する食品成分などが見出されてきている [21]。本稿でも述べてきたが、食品成分による直接的な褐色脂肪組織機能の活性化のみならず、食事成分の腸内細菌代謝産物による褐色脂肪組織機能調節機構の存在も示唆されることから、プレバイオティクス、プロバイオティクス、ポストバイオティクス的手法を用いた褐色脂肪組織機能制御による肥満症対策への実用化も期待される。また、実験動物においては運動や寒冷刺激とカプシノイド摂取という、褐色脂肪組織機能を亢進させる複数刺激の組合せによって、より効果的に褐色脂肪組織機能の亢進が惹起されるとの報告もあり [22, 23]、食品成分の利用を基軸とした科学的エビデンスに裏付けられた有効な褐色脂肪組織機能制御法の確立と応用を期待したい。 6. 謝辞本稿で紹介した私達の研究は、主に京都大学大学院農学研究科食品生物科学専攻食品分子機能学分野で多くの教職員・学生の方々のご協力のもと行われました。同時に、北海道大学大学院獣医学研究院の斉藤昌之名誉教授、木村和弘教授、岡松優子准教授、京都大学大学院農学研究科の小川順教授、岸野重信准教授、自然科学研究機構生理学研究所の富永真琴教授、内田邦敏助教(現静岡県立大学准教授)、福井県立大学生物資源学部の村上茂教授および大阪薬科大学薬学部の馬場きみ江名誉教授、谷口雅彦教授をはじめとする多くの共同研究先の先生方のご指導のもと実現することができました。深く御礼申し上げます。 7. 参考文献
略歴
京都大学大学院農学研究科修士課程修了後、日本たばこ産業株式会社医薬総合研究所にて研究員として勤務。 京都大学大学院農学研究科博士後期課程修了後、日本学術振興会特別研究員(PD)、岐阜大学応用生物科学部・助教、京都大学学際融合教育研究推進センター・特定助教、京都大学大学院農学研究科・助教を経て、2014年10月より現職。 この間、日本農芸化学会 農芸化学奨励賞(2018年)等受賞。 サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |