|
フェニルエタノイド配糖体の魅力と謎 -ゴマ葉からのチャレンジ-
日本大学 生物資源科学部 食品生命学科
教授 松藤 寛 1.はじめにフェニルエタノイド配糖体(PhGs)は、水溶性のポリフェノールで、C6-C2にβ-グルコピラノース(β-グルコース)が結合した構造を主基本骨格とし、これに種々の糖や桂皮酸類が結合した形で、天然に広く分布している。多くの薬用植物に共通したPhGsが含まれることから、植物の化学系統分類学ケモタキソノミー指標として注目される一方で、様々な薬理作用をもち、また最近ではアルツハイマーやパーキンソン病への in vivo効果やその特異的作用機序が報告されるなど、医薬品として、またこれらをリード化合物とした創薬利用も期待されている。しかし、最も幅広く存在し、代表的なPhGs化合物として知られるアクテオシド(別名ベルバスコシド、クサギニン)でさえ、その大量発現系が構築されておらず、疾病治療に用いるための量産化が課題となっている。 本稿では、PhGsの魅力と謎について、ゴマ葉からの問題解決に向けた我々の取り組みを紹介する。 2. 天然中に存在するフェニルエタノイド配糖体(PhGs)
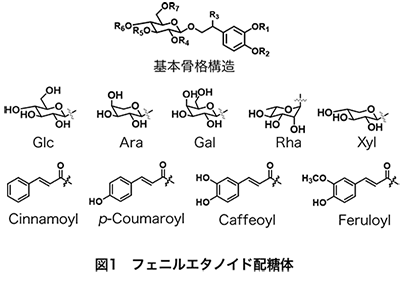
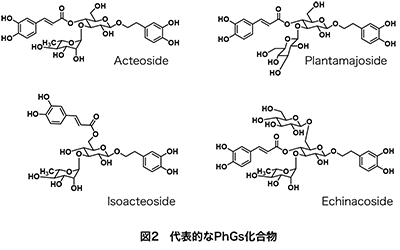
図1に示すように、PhGsはC6-C2にβ-グルコースが結合した構造を主基本骨格とし、これに種々の糖や桂皮酸類が結合した形で天然中に存在する。糖の種類(アラビノース、ガラクトース、ラムノース、アロース、キシロース、アピオース、リキソースなど)や結合する糖の数(主に1~3)、その結合位置の違い、さらに結合する桂皮酸類の種類(桂皮酸、p-クマル酸、カフェ酸、フェルラ酸、シナピン酸などに加え、アセチル基やフェノール酸類)や結合数(主に1~2)により、その構造は多岐にわたり、これまでに500種以上のPhGsが報告されている1~3)。 代表的なPhGsの化合物例を図2に示す。ヒドロキシチロソール-1-O-グルコシドのグルコースユニットの3位にラムノース、4位にカフェ酸が結合したアクテオシド(別名ベルバスコシド、クサギニン)は最も代表的なPhGsとして知られる。これは、イワタバコ(Conandron ramondioides)、ツノゴマ(Proboscidea louisiana)、ブルーエルフィン(Clerodendrum myricoides; 現分類Rotheca myricoides)、テンニンソウ(Leucosceptrum japonicum)、ハマウツボ(Cistanchis herba)、チョロギ(Stachys sieboldii)、オオバコ(Plantago asiatica, Plantago depressa)、ジオウ(Rehmanniae radix),オリーブ(Olea europaea)など, 20科77属150種以上の様々な薬用植物に幅広く存在するとされている4)。一方、イソアクテオシド(イソベルバスコシド)は、アクテオシドのカフェ酸位置異性体である。アクテオシドを含む植物中にイソアクテオシドも一緒に見出されることが多いが、アクテオシドの存在量に比べイソアクテオシド量は微量であることが多い。
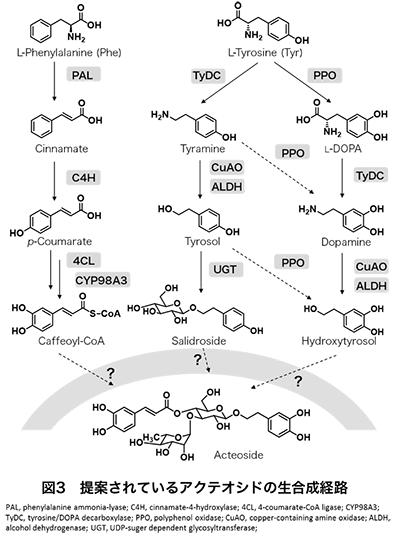
なお、アクテオシドは、1963年モウズイカ(Verbascum sinuatum)から初めて見出され、このときベルバスコシドverbascoside5)と名付けられたが、当時の分析機器では構造決定が不完全であり、結合部位が明らかにされていなかった。その後、1968年にライラック (Syringa vulgaris)の花より見出されたPhGsの化学構造がNMR等を用いて初めて明らかにされ、これがアクテオシドacteoside6)と命名された。以降、いろいろな植物からアクテオシドの存在が報告される中、1982年にベルバスコシドとアクテオシドが同一のものであることが明らかにされた7)。ベルバスコシド名に統一しようとする動きもあったようであるが、結局どちらの名前も登場し、現在はアクテオシドとベルバスコシドの名前を並記して使うようになっている。さらに、同時期1983年にSakurai と Kato8)はクサギ (Clerodendron trichotomum)より見出したアクテオシド(ベルバスコシド)を新しいPhGs、クサギニンkusagininと名付けたため、アクテオシドを検索するときは注意が必要である。同様の問題は他にも見られ、アクテオシドのラムノースがグルコースに置き換わっているプランタマジョシドplantamajoside(図2右上)も別名が存在する(purpureaside Aともいう)。その他、ラバンデュリフォリオシドlavandulifoliosideも複数の名前を有する(stachysoside Aやstachysoside Bと言われる)。ややこしいが、当時の研究がいかに活発で、研究論文を早く出すという先人の気概が垣間見え、興味深い。なお、プランタマジョシド9)は生薬シャゼンソウ中の主要活性成分の一つとされており、ラバンデュリフォリオシド10)はヨーロッパや中央アジアに分布する薬草Leonurus cardiacaに含まれるPhGsである(ラバンデュリフォシドはアクテオシドのラムノース2位にアラビノースが結合した三糖配糖体)。 エキナコシドechinacosideはPhGsの中で最も古く、1950年にエキナセア (Echinacea angustifolia) から見出されたPhGsである。構造は1982年に明らかにされ、アクテオシドのグルコース6位にさらにグルコースが結合した三糖配糖体の構造で、エキナセアやカンカニクジュヨウ(Cistanche tubulosa)に多く含まれる。エキナコシドは10科18属40種以上の薬用植物に含まれる代表的なPhGsの一つである11)。 このように、PhGsは類似した構造が多く、また植物により様々であるが、一種類のPhGsが存在するのではなく、植物中では数多くのPhGsが存在する。例えば、エキナコシドとアクテオシドを多く含むカンカニクジュヨウには、マイナーではあるが、その他26ものPhGsを含むことが報告されている12)。それゆえ、いわゆるこれら植物二次代謝産物の組成、構造やその推定される生合成経路から植物の系統を分類しようとする化学系統分類学ケモタキソノミーの指標としても、PhGsは注目されている。 3.PhGsの様々な薬理作用、及び現状の問題点一方で、PhGsは様々な薬理作用を有することから、その効果についての研究も活発に行われている。すなわち、PhGsを含む薬用植物の多くが生薬として、また民間薬や伝承薬として利用されていることから、その活性本体としてPhGsの関与が調べられ、in vitroやin vivoでの様々な活性(抗酸化、抗炎症、抗ガン、抗菌、抗ウィルス、鎮痛、神経保護、肝保護作用など)が明らかにされている。これらについては枚挙にいとまがないほどの論文が報告され、詳細はそれぞれの論文や総説を参考にしていただきたい。Alipievaら13)はアクテオシドで総説をまとめ、その中で様々な薬理作用やメカニズムを紹介している。またRavnら9)はプランタマジョシドの様々な作用を、Liuら11)やMorikawaら12)はエキナコシドやそれを含むエキスの様々な作用を紹介している。最近では、アルツハイマー14,15)やパーキンソン病16)へのin vivo効果やその特異的作用機作が報告されるなど、いずれのPhGsも医薬品として、またこれらをリード化合物とした創薬利用が期待されている。 ただ、PhGsは様々な薬理作用が明示された80~90年代以降から今に至るまで「医薬品としての利用」が期待されている。これは、最も幅広く存在し、代表的な化合物であるアクテオシドさえ、その大量生産系が構築されておらず、疾病治療に用いるための量産化が大きな課題となっているためと考えられる。PhGsを豊富に含む植物の探索、化学合成や高含有植物細胞を用いたバイオ生産に関する報告はあるものの、例えばアクテオシドを豊富に含む植物は稀であり、多くの薬用植物中での含有量は0.02~0.4%程度と少ない。このようなことから、アクテオシドの効率的な抽出法の特許も存在する。また、アクテオシドの化学合成17, 18)も報告されているが、アクテオシドはグルコースユニットの3位にラムノース、4位にカフェ酸が結合する特異的な構造のため、官能基の保護と脱離を繰り返し行う複雑な多段階の合成ステップが必要で、低収率である(15ステップ、4.4~7.1%)。複雑な操作は、価格に反映され、結果的に高価格となることが予想される。そのようなことから、安価な製造が可能な植物細胞を用いたバイオ生産が多く検討されている。しかし、バイオ生産も高生産植物細胞同士で形質転換19)するなど工夫されているが、生合成関連遺伝子や酵素が不明なため、効率的な細胞が作製できず、生産量が少ないのが現状である。そのため、生合成機構解明やそれに基づく生物工学的手法による量産化が求められている。 4.アクテオシドの生合成経路PhGsの生合成として、アクテオシドの生合成経路がオリーブ20)、アカヤジオウ21)、レンギョウ22)の植物体や培養細胞を用いた検討より報告されている(図3)。これらの中で、フェニルアラニンからのカフェ酸ユニットの生合成経路は、フラボノイドやポリフェノール生合成の中間体となるため、精力的に研究され、様々な植物で明らかにされている。すなわち、フェニルアラニンは、phenylalanine ammonia-lyase(PAL)により脱アミノ化され、桂皮酸を形成し、次いでcinnamate 4-hydroxylase(C4H)により、芳香環の4位に水酸基を付加し、p-クマル酸を形成する。p-クマル酸からカフェ酸CoAへは、4-coumarate-CoA ligase(4CL)及びCYP98ファミリー(CYP98A3)によりp-クマル酸CoAを経てクマル酸CoAもしくはカフェ酸を経てカフェ酸CoAが合成される。
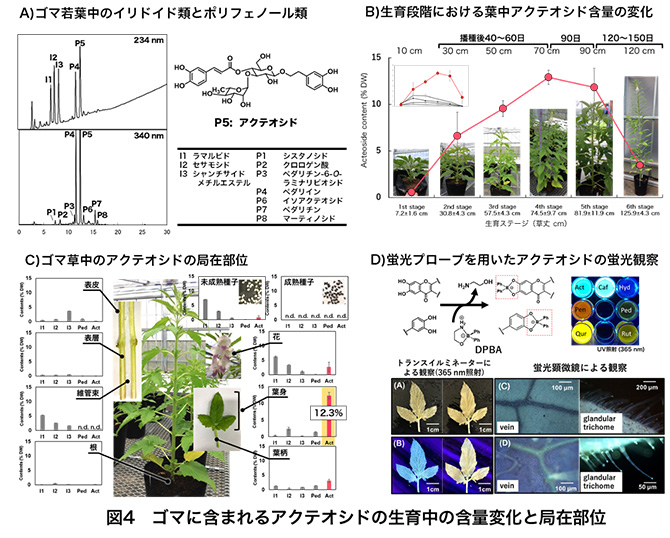
一方、ヒドロキシチロソール及びサリドロサイドの生合成は、ライラックやオリーブの培養細胞を用いた同位体取り込み実験からの経路や、トランスクリプトーム解析により候補遺伝子が見出され、関与する酵素が推定されている。酵素略記名は論文によって異なるが、チロシンからtyrosine/dopa decarboxylase(TyDC)によりチラミンを形成し、次いでcopper amine oxidase(CuAO)及びalcohol dehydrogenase(ALDH)が反応を触媒し、チロソールへ、さらにUDP-sugar dependent glycosyltransferase(UGT)によりサリドロサイドへと至る経路と、チロシンからpolyphenol oxidase(PPO)により水酸基が付加され、L-DOPAを形成し、TyDCによるドーパミンを経て、さらにCuAOとALDHにより脱アミノ化及びカルボキシル化され、ヒドロキシチロソールへと至る経路が提案されている。ただ、いずれの酵素遺伝子も数~数十の候補遺伝子が選抜されているのみで、機能解析されていないため、十分に解明されておらず、どちらの経路が主経路か不明である。加えて、いずれの論文においても、アクテオシド生合成上流の議論のみで、生合成下流すなわちカフェ酸CoAやサリドロサイドまたはヒドロキシチロソールからのアクテオシド生合成については、中間体が全く検出されておらず、C6-C3から配糖体、アシル化体へと至る生合成経路の詳細は不明である。植物体や使用株のアクテオシド生産性が低い場合、関連酵素や遺伝子の発現量も低くなり、また他のポリフェノールや様々なPhGsを作り出す場合、これら夾雑物由来の妨害により、詳細な生合成経路の解明が困難になっていると予想される。 5.アクテオシドを高生産するゴマ葉の魅力と謎やっとゴマの話になるが、ゴマ(Sesamum indicum L.)は、ゴマ科ゴマ属の一年生の草本で、アフリカやアジア、南米の熱帯から亜熱帯地域において広く栽培されている。葉は、アフリカやアジアでは一部食用として、または痛み緩和の伝承薬として利用されているが、ゴマは利用価値の高い種子の供給を目的として栽培されているため、葉などは大量の農業廃棄物となっている。そのため、ゴマ葉への注目は低く、報告例も少ない。このような中、健康志向と相まって、ゴマの若葉粉末が健康食品素材として市場に出回るようになった。ゴマ若葉粉末はポリフェノールを豊富に含む(1.3-1.8%)とされるが、その成分の詳細は不明であったことから、ゴマ若葉乾燥粉末の成分分析に着手した。結果、アクテオシドが主要成分の一つであり、ゴマ若葉乾燥粉末中に1.2%ほど含まれることが判明した23)。アクテオシドを豊富に含む植物は稀であり、また様々な薬理作用が明らかにされていることから、興味をもち、ゴマ葉の研究を続けている。 図4に様々な結果24,25)をまとめて示すが、ゴマ葉には3種のイリドイド類(I1~I3)と8種のポリフェノール類が含まれる(図4A)。播種するゴマ成熟種子には存在しないが、生育とともにアクテオシド量が増加し、開花-莢形成前の草丈70 cmくらいのときに葉中含量が最大12%以上となり、その後莢形成期、種子成熟期となるにつれ急激に減少していく(図4B)。アクテオシドの最も主要な局在部位は、葉身(12.3%)であり、続いて葉柄(3.1%)、花(2.7%)、未成熟種子(0.84%)となり、根や茎(表皮、表層、維管束)、成熟種子には存在しない(図4C)。カテコール構造をもつ化合物を蛍光染色して存在部位を可視化できるDPBA(diphenylborinic acid 2-aminoethyl ester)を用いて、葉を蛍光染色し、UV照射下及び蛍光顕微鏡で観察すると、アクテオシド-DPBA複合体に由来する青色蛍光体が葉脈と葉全体に存在するトライコーム(毛状突起)に観察され、アクテオシドは葉脈を通ってトライコームに蓄積する(図4D)。アクテオシドを12%以上も含む植物は報告例がなく、ゴマはアクテオシドを高生産する稀有な植物であること、また葉柄から葉身にかけて含量が増加していることから、葉柄及び葉身内でアクテオシドは生合成され、そして葉脈を通ってトライコームに蓄積することが判明している。
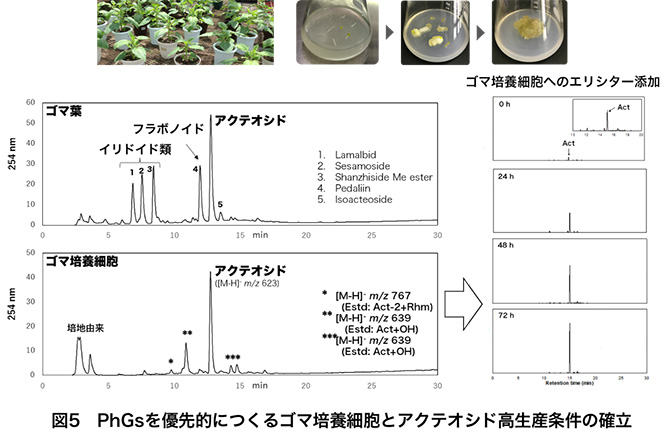
一方、このとき図3に示したアクテオシド生合成の前駆体すべてをLC-MS/MSで分析してみると、アクテオシドを12%以上もつくるにもかかわらず、フェニルアラニン(tr~0.02%)とチロシン(tr~0.01%)がわずかに検出されるだけで、他の前駆体は根、茎、葉、花のいずれの器官でも全く検出されなかった。また、根や葉柄からのラベル化体等の前駆体の取り込み実験やこれらを基質として葉酵素抽出物からの変換実験も行ったが、うまくアクテオシドまで変換されない。その他の検討で、ゴマ種子特有成分であるセサミン等のリグナン類を豊富に含む種子の方がアクテオシドを多く生産する傾向があり、生合成的に何か関係があるのか?花、未熟種子、成熟種子となるにつれてアクテオシドが減少することと、未熟種子から成熟種子になるにつれてリグナン類が増えていくこととは何か関係があるのだろうか?アクテオシドを大量に生合成し、葉に12%も蓄積するのはなぜなのか?トライコームへの蓄積は植物の防御機構と考えられるが、開花-莢-種子形成後に葉中アクテオシド量が減るということは何か役目を終えたのだろうか?また構造的に見ると、カフェオイル基がグルコースの4位に結合する特異的な構造で、なぜ6位に結合するイソアクテオシドが主要ではないのか?このような特異的構造のアクテオシドを様々な薬用植物が共通して含むのはなぜなのか?など天然物化学的に不可思議で興味が尽きない。 また、アクテオシドやPhGsの利用を見ると、様々な薬理作用を示し、また最近ではアルツハイマーやパーキンソン病にも効果があることが示され、今後ますます医薬品としての創薬・利用が期待される。しかし、量産化の手法が確立されていないという問題を有する。アクテオシド生合成上流はフライボイドやポリフェノール生合成経路として数多くの論文があり、よく知られている経路であるが、前駆体が全く検出されないことは甚だ不思議である。下流に行くにつれて酵素活性が高くなっているということなのか?未だ不明なアクテオシドやPhGsの生合成機構の解明は、これらの様々な疑問や問題を解決する鍵となると考えられる。このような中、我々はアクテオシドを高生産するゴマ培養細胞株を入手することができた(図5)。この株は、イリドイドやフラボノイドは生産せず、アクテオシド等のPhGsを生産し、あるエリシターを添加するとアクテオシドのみを高生産する。したがって、アクテオシド生合成関連遺伝子や酵素を「有意に」検出できることが期待される。まだまだ分からないことだらけであるが、この細胞株を用いることで、これまでずっと不明であったアクテオシド生合成にかかわる関連遺伝子や酵素の解明、さらには大量バイオ生産が可能になると夢見ている。
参考文献
略歴
現在に至る。 サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |