|
フードミクスで食品の品質を評価する
神奈川工科大学 健康医療科学部管理栄養学科
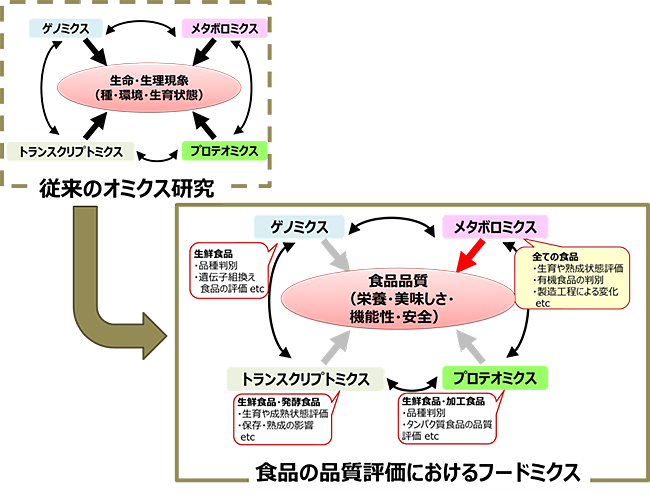
教授 飯島 陽子 1.はじめに:フードミクスとは?近年、ゲノミクスやプロテオミクス、メタボロミクスなど、「Omics (オミクス)」研究が盛んである。オミクスとは、生育状態や生育環境、病態などの違いにより生体中に存在する分子全体を網羅的に調べ、その量的変化から生命現象を捉えようとするもので、近年発展してきたシステム生物学の基盤となる研究手法といえよう。そこに共通しているのは“網羅性”であり、特に複雑系に埋もれた、ある変化を網羅的分析によってくまなくとらえ見出す点に特徴がある。すなわち、あらかじめ特定の遺伝子や代謝物にターゲットを絞ったものでなく、特定の条件における多種多様な変動を同時に捉え、そこから発現遺伝子間、代謝物間の相関性の解明やマーカーとなる分子の発見を見出す。そのため、その現象に直接的に関与する、依存する分子の量的変化を見出すことができる。 代謝物の網羅的分析手法としてメタボロミクスが知られる。代謝物の多くは低分子有機化合物であるが、遺伝子やたんぱく質と違って、代謝物によってそれぞれ化学的特性が大きく異なるため、抽出や分析方法の工夫が必要であること、未知成分をどのように取り扱うかなど、難点が残る。しかし、近年の分析技術や解析技術の発展によって、その分析法が徐々に開発されてきた。食品はそもそも植物や動物、微生物由来の食材からなり、食品成分は各食材における代謝物そのもの、さらにそれが多様化したものであるといえる。食材の産地や品種の違い、発酵保存、調理条件など生産現場から食卓で食するまでに食品は様々な条件下に置かれ、それによって容易に成分組成の変化が起こり、品質に影響を与える。また、食事として食した後も生体内で消化され成分変化が起こる。その変化はまさに複雑系で起こる現象であり、メタボロミクス技術を応用することが可能である。 近年、オミクス技術を食品評価に活用したものを“フードミクス(Foodomics)”と呼ぶようになった。特に食品の加工では、酵素反応などの生化学的変化のみならず非酵素的な化学的変化による成分変動も多く、より複雑である。フードミクスでは、メタボロミクス技術を食品分析に活用して食品成分を網羅的に分析し、食品の品質や栄養的価値への影響を探る研究手法として捉えられている(図1)1)-3)。本稿では、現在のフードミクスの分析や解析手法、その活用について概説する。
図1.オミクス解析の食品分析への応用“フードミクス” 2.フードミクスにおける分析と解析オミクス研究の根幹は、分析機器の進歩もさることながら、膨大なデータを解析するためのツール開発等、インフォマティクスによる解析技術開発によるものといえよう。前述したとおり、フードミクスによる分析は網羅的成分分析であるメタボロミクス分析技術と関係が深い。本分析では、①サンプルの抽出、成分分離およびノンターゲットな成分検出、②多サンプルデータの比較解析、③サンプルの違いおよび寄与成分の可視化により成り立つ。フードミクスによる網羅的成分分析の概要を図2に示す。
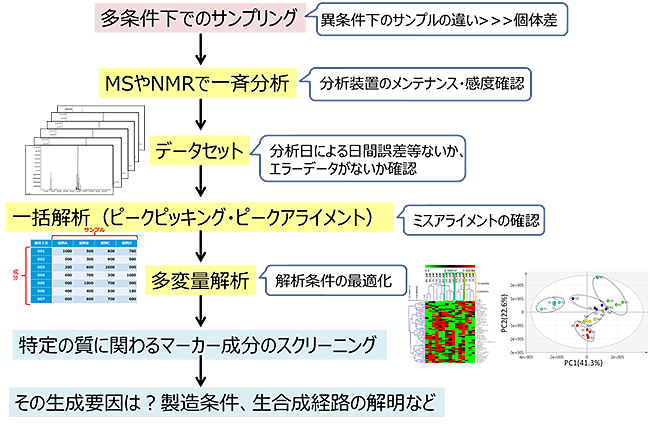
図2.フードミクスにおける網羅的分析手法の概要
一般に網羅的分析は、質量分析計(MS)と核磁気共鳴装置(NMR)で分析されるのが主流である4)5)。しかし、食品成分は、糖やアミノ酸などの水溶性成分からカロテノイド、脂肪酸などの脂溶性成分まで化学的特性(特に極性の違い)、分子量の違いが大きい。そのため網羅的分析とはいえ、ある程度成分の極性を考慮した抽出法を採用し、複数の分析データを合わせて解析されることが多い。MSによる分析は、分子量やフラグメントイオンによる部分的構造の情報を得ることができる6)。MSに接続された成分分離操作として液体クロマトグラフィ(LC)、ガスクロマトグラフィ(GC)、キャピラリー電気泳動(CE)が汎用されている。また、各成分の質量や部分構造が異なる成分であれば、完全にピーク分離されなくともかなりの成分について網羅性の高い検出が可能である点が利点である。しかし多くの場合、サンプルの粉砕、抽出操作、成分分離操作などの前処理が必要であることから、この間に起こる成分変化や回収率のサンプル間誤差など注意する必要がある。近年、MSイメージングにより特定成分の局在性を可視化する技術も報告されるようになり、今後さらに発展することが期待されている7)8)。一方、NMRによる分析の利点はそのハイスループット性にある。成分分離操作がないため、液体サンプルまたは抽出液を直接分析することが可能で、その分析時間も短い9)10)。またサンプルによる機器の汚染がないため、データの再現性の良さも評価されており、プロトンNMRでは、検出成分の定量性も確保されている。そのため、短期間で良質なデータを大量に得ることができる。ただしMSに比べると感度は低いため、微量成分の検出が困難なこともある。 次に、多サンプルから得られたデータ処理をどのように行うか、について述べる。各データの成分ピークを一つ一つ拾っていくことは時間がかかる。現在は多サンプルデータについて一括でピークピッキング(成分ピーク拾い)、ピークアライメント(多サンプル間で検出された同一成分ピークを並べること)を行うソフトウエアが機器メーカーから、またフリーでも入手が可能であり、このようなインフォマティクスの貢献により解析スピードが大幅に上がっている。ただしソフトウエアの過信は禁物であり、ピークのミスアライメントが発生することもあるため、最終的には目視などによって確認チェックすることも必要である。最終的に、縦軸にピークID、横軸にサンプル行列が並んだ、データセットが出来上がる。本データを用いて主成分分析やボルケーノプロット、相関ネットワーク解析などのケモメトリクスに基づく多変量解析を行い、サンプル間の違いの可視化、特定のサンプルに寄与する成分ピークをスクリーニングすることができる。 ここでの難点としては、クローズアップした成分が既知成分であるか未知成分であるか?である。既知成分で標準品の入手が可能であれば、標準品との各種スペクトルの比較から同定、定量が可能であり、研究の進みは早い。一方未知成分である場合は、様々なアプローチが考えられる。最も一般的であり信用があるのは、抽出物から単離し、NMRやMSで構造決定する天然物化学的手法である。労力やコストはかかるものの、本手法が最も明確であるといえよう。と同時に、近年未知成分についていかに化学的情報(アノテーション)を付すことができるか、についての取り組みも多い。文献情報に基づく代謝物データベースの構築や標準品を用いたMSライブラリの充実など様々なデータベースが公開されている11)12)。 3.フードミクスの食品の質的評価への応用フードミクスデータの活用について近年多くの報告がされるようになった。生鮮食品、加工食品、発酵食品問わず安全性評価、嗜好性評価、生理活性成分のスクリーニング、品質管理など、その応用研究についての報告は多岐にわたる。 食品衛生面では、毒素成分のLC-MSによる網羅的分析によって微生物汚染食品のスクリーニング13)、検出成分に基づく汚染微生物種の判別への応用が可能であることが分かった14)。また、食の安全性評価という意味では、有機食品と従来食品の差異について客観的評価法にメタボロミクス技術が活用されている15)。さらに、ジャガイモ、大豆やトマトなどにおいて、遺伝子組換え作物と従来品との比較、“実質的同等性”の評価についてもメタボロミクスが応用され16)、これらもフードミクス研究といえよう。 食の嗜好性におけるフードミクスの活用例も多い。特に、香りや味などの嗜好性成分の網羅的分析データと官能評価データとの統合解析により、様々な食品における特定の風味特性に関与する成分のスクリーニングがなされている17)。また、食品製造過程、例えば発酵や加熱における風味変化についても、網羅的成分解析によってその風味変化に寄与する成分の特定を行うことができ、さらにはその生成メカニズムについて掘り下げることができる。 さらに、機能性食品の評価、栄養評価においてもフードミクスは注目されている。例えば、機能性成分を豊富に含む食材の選抜などが挙げられる。さらには食品の質や栄養に関するバイオマーカーの探索、食事摂取後の血液や尿を用いた代謝物の網羅的分析から栄養評価を行おうという試みなど、まだその活用の裾野は広がっており18)、今後も技術的進展による応用が期待されている。 4.さいごに複雑系における成分分析をあえてそのまま行おうとするには、例えば天然物化学、分析化学的な思想からすると大雑把に思われがちであり、特に未知成分を含めたノンターゲット分析では、そのあいまいさが指摘されることもしばしばある。しかしながら、初めは未知成分であっても、ある特定の条件下に置かれた食品において鍵成分であること、その意義があることが分かれば、そこで構造について精査すればよい。現在、生産現場から我々が食するまで、食品の品質変化は多段階でおこる。フードミクスによる研究アプローチは、食品品質の包括的理解につながるといえよう。 参考文献
略歴
1999年 お茶の水女子大学大学院人間文化研究科博士課程修了(博士(学術))。お茶の水女子大学大学院助手、ミシガン大学分子細胞発生生物学部博士研究員、 (公財)かずさDNA研究所研究員を経て2010年神奈川工科大学応用バイオ科学部栄養生命科学科に准教授として着任。2016年より同教授。2020年より学部改組のため神奈川工科大学健康医療科学部管理栄養学科教授。 サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |