|
味覚研究の新展開
東京農業大学 応用生物科学部 食品安全健康学科
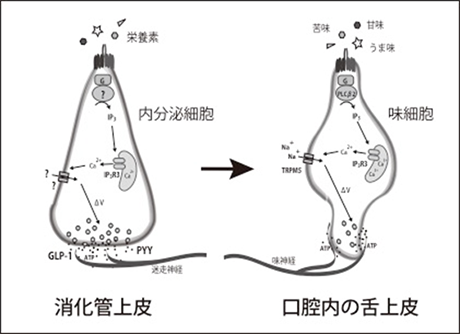
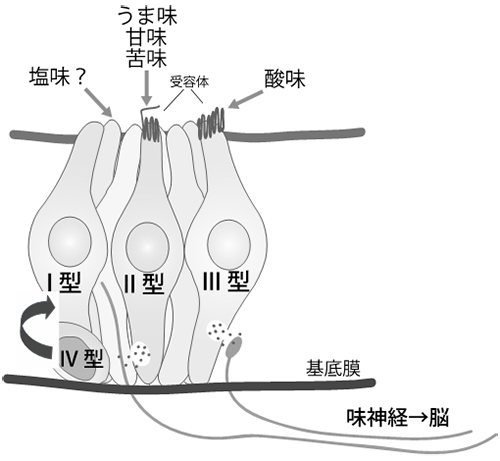
准教授 岩槻 健 1)はじめに食べる行為は、生きていく上での必然である。我々は食べることが好きであり、食べることでこの欲望は満たされる。その最初のスイッチを、口腔内や消化管に存在する味細胞が担っている。味細胞が舌上皮に存在することは生物学を学んでいなくても感覚的に理解できるが、その味細胞が味を感じる仕組みについては意外に知られていない。本メルマガでは、理解が進んできた味覚受容メカニズムと、味覚研究の課題について、著者の専門である分子細胞生物学からの視点で語りたい。 2)化学感覚としての味覚我々は視覚、聴覚、触覚、嗅覚、味覚の五感により外界からの情報を得て、ある時は危険を回避し安全な場所へ避難し、またある時はうまい匂いに惹きつけられ栄養価の高い食事にありつく。この五感の中で嗅覚と味覚は化学感覚(Chemical Sense)と呼ばれ、匂い物質や味物質(呈味物質)などの化学物質を検知する特殊な感覚である。匂い物質を最初にキャッチするのは鼻腔内の嗅上皮に存在する嗅細胞であり、呈味物質を感知するのは口腔内の舌上皮に存在する味細胞(Taste Cell)である。嗅細胞と味細胞は化学物質を受容するという意味では似ている。しかし、嗅細胞は外胚葉由来の神経細胞であるのに対し、味細胞は内胚葉由来の上皮細胞であり由来も性質も異なっている。味細胞に由来も性質も似た組織として、消化管上皮細胞が挙げられ、消化管内分泌細胞は味覚受容体や味覚受容関連分子を発現し、甘味物質を感知し、インスリンの分泌を亢進するホルモンであるGlucagon-like protein-1(GLP-1)を分泌することが分かっている1)。太古の昔には、消化管と簡単な神経系しか持たない生物が繁栄したが、長い進化の過程で安全に効率よく栄養素を摂取できる生物が誕生し、その生物は複雑な消化管の先端に舌を配置し、外界から体内に入る物質が安全で栄養価が高いか危険かを瞬時に判断できるよう味細胞にゲートキーパーの役割を課したと考えられる2)(図1)。味細胞は通常、100-150個の集合体である味蕾として存在する。電子顕微鏡写真像から味細胞はI型(暗細胞)、II型(明細胞)、III型(中間細胞)、IV型細胞(基底細胞)に分類されてきたが、今日ではII型細胞は甘味、うま味、苦味受容細胞、III型細胞は酸味受容細胞、IV型細胞は味幹細胞か前駆細胞ということが分子マーカーの発現により分かっている(図2)。I型細胞は、最も解析が遅れている細胞であり、未だにその機能は謎である。
図1 消化管内分泌細胞と口腔内の味細胞
図1:解説
図2 味蕾の構造
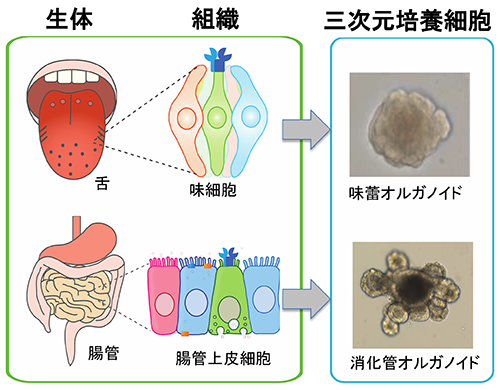
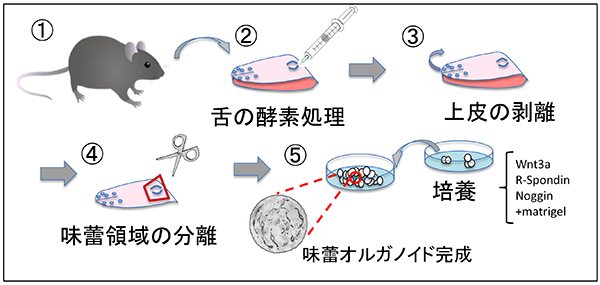
図2:解説 3)嗅覚および味覚受容体嗅覚と味覚のうち、受容体レベルでの研究が最初に進んだのは嗅覚である。化学感覚の研究は生理学的手法を中心に行われてきたが、1991年にBuckとAxelが分子細胞生物学的手法を用い、嗅覚受容体はGタンパク共役型受容体(GPCR)であり、巨大なファミリーを形成していることを発見した3)。この発見により、嗅覚研究は一気に進み始めることになる。その後、嗅覚受容体がマウスでは約1000種類も存在することや、嗅覚受容体に匂い分子が結合しその結合パターンにより様々な匂いが生じることが分かり、現在では匂いやフェロモンと行動の関係について理解が深まっている。一方、味覚研究は嗅覚研究に後塵を拝していた。1994年、MargolskeeらはGタンパク質のα-gustducinを発見し4)、味細胞に存在し甘味と苦味伝達に重要であることを報告したが5)、味覚受容体の同定にはしばらく時間がかかった。2000年前後にようやく苦味受容体(Tas2r)、甘味受容体(Tas1r2+Tas1r3)、うま味受容体(Tas1r1+Tas1r3およびmGluRs)が報告された6,7)。 残りの味質である酸味と塩味については、いくつもの受容体候補が発表され、イオンチャンネルであろうということが示唆されていた。酸味受容体についてはASICs、PKDL1/3、OTOP1など様々なチャネル分子がこれまでに報告されてきたのにも関わらず、決定的ではなかった8-10)。ごく最近、OTOP1欠損マウスを使い同分子が酸味受容体であるとの報告があった11)。同報告はさらに、酸味は他の味質とは独立したシグナルとして中枢に伝えられること、他の体性感覚とも違うことを、組み換え動物と特定の神経を標識することにより見事に証明している。酸味受容体についてはこれで決着がついたと思われる。 塩味受容システムは、アミロライドに対する感受性がある・なしで2種類あると考えられている。前者は低濃度のNa+受容のことを指し、受容体としてENaCというチャネルが報告されている12,13)。後者のアミロライド非感受性の塩味は、高塩濃度溶液で反応を引き起こす。この塩味はナトリウム塩である必要がなく、KClなど他の塩でも同様の反応が起こる14)。同反応の一部はAITCにて阻害され、苦味受容はAITCにおいても阻害されるので、苦味受容細胞が高塩濃度に反応する細胞の一つであることが示唆されている14)。しかし、高塩濃度に対する受容体の本体については明らかにされていない。 4)その他の味覚5基本味以外の味質で「第6の味」が存在する可能性はあるか?という問いを頻繁に耳にする。5基本味以外で注目されているのが脂肪酸の味である。パンにバターやマーガリンをつけたり、野菜炒めに野菜油を使ったり、日々の食に油脂は欠かせない。やはり油脂は美味しいのである。食品に含まれる油脂は口腔内のリパーゼにより脂肪酸に分解され、脂肪酸受容体であるGPR40やGPR120や脂肪酸トランスポーターであるCD36 を発現する味細胞により感知されると考えられている。しかし、脂肪酸には他の5基本味のように独立した「味」があるのかどうかは証明されていなかった。最近、安松らは脂肪酸に特化した神経の存在を明らかにし、その神経応答がGPR120を欠損したマウスで消えることから、GPR120を通じて脂肪酸の味が伝わると報告している15)。GPR120以外にも脂肪酸受容体候補は存在するため、それら受容体からも独立した味シグナルが流れるのか、他の味質を修飾するシグナルとなっているのか、今後の研究に注目したい。 もう一つ、5基本味以外の味で話題にしばしば挙がるものに、コク味がある。コク味はまだ定義が曖昧であり、統一した見解がない概念である。しかし、我々はコーヒー、チョコレート、ビール、ラーメン、シチューなど、嗜好品から日々の食事まで幅広い食品にコク味を求めている。この正体不明の味に対し、その受容メカニズムの解明に挑んだ研究もある。しかし、コク味の定義をしっかりとさせ、次にその受容機構の存在を確認し研究を進めるべきであろう。 5)味細胞から味神経への情報伝達味細胞から5基本味の味シグナルが発せられた後、その情報はどのように中枢へ伝えられるのだろうか?味細胞は上皮細胞であるため、受け取った呈味物質のシグナルは味神経へと伝えられなければならない。甘味、うま味、苦味受容を担うII型味細胞と味神経はシナプスを形成しないことが知られているが、神経終末がどのようになっているかは不明である。これまで分かってきたことは、味シグナルを伝達する神経伝達因子としてATPが使われていることである16)。また最近、味細胞の膜上にCAHLM1-CAHLM3複合体が存在し、味細胞が興奮した際にATPを通すチャネルとして機能することが判明した17)。しかし、分かっていないことも多い。先に述べたように、II型味細胞と味神経はシナプスを形成しないのにも関わらず、ATPは味細胞から放出され特定の味神経に伝達される。ATP受容体は多くの細胞で発現しているので、かなりローカルで閉鎖的な環境でないと味細胞と味神経の1:1の関係は構築できない。さらに、味細胞は2週間に一度再生するので、この間に味神経終末は死んでいく味細胞から離れ、同じ味質を感知する味細胞に新たに繋ぎ替えられなければならない。一体どのようにしてパートナーを失った味神経は新たなパートナーに接近するのだろうか。そのメカニズムを理解するために、Zukerらは味細胞に選択的に発現する軸索誘導分子を探し、Sema3Aは苦味受容細胞に、Sema7aは甘味受容細胞に発現することを見出した。これら分子を異所的に発現させた結果、苦味や甘味受容システムに変化が起こることを示した18)。このことは、味神経と味細胞が軸索誘導分子依存的にパートナーを選択している可能性を示している。将来は、特定の味神経を人工的に興奮させることや、嫌いなものを美味しく食べさせることが可能になるかもしれない。 シナプスを形成しないII型味細胞と味神経の関係についての研究を紹介したが、酸味受容細胞であるIII型味細胞は、味神経とシナプスを形成することが分かっている。しかしながら、神経伝達物質が何であるかは、まだ決定されてはいない。III型味細胞もII型味細胞と同様に再生を繰り返すが、軸索誘導分子についてもIII型は分かっていない。 6)新たな技術導入と研究対象の選択6−1)味蕾オルガノイド前述してきたように、味覚受容体についての研究はかなり進んできた。しかし、味細胞がどのように再生し成熟するのか、センサーとしての味細胞の性質についての研究は緒に就いたばかりである。というのも、これまで味細胞を培養する術がなかったからである。これまで研究者たちは味細胞の代わりに、消化管のがん細胞由来の株化細胞を利用してきた。しかし、株化細胞は特定の機能しか解析できない。ましてや、すべての味細胞に分化する幹細胞の研究は株化細胞では無理であった。目を別の組織に向けると、消化管研究では2007年にクリプトに存在する幹細胞のマーカー分子(Lgr5)が発見され19)、その2年後には幹細胞三次元培養系である消化管オルガノイド培養系が確立された20) (図3)。味細胞が消化管上皮細胞と同じ内胚葉由来であると考えていた我々は、味幹細胞も消化管の幹細胞と同一のマーカーを持つと考え、有郭乳頭周辺にLgr5陽性の味幹細胞が存在することを見出し21)、その後、Lgr5陽性細胞を含む舌上皮より味蕾オルガノイド培養系を確立した22)(図3、4)。この味蕾オルガノイド培養系では、味幹細胞を維持するだけでなく、全ての味細胞への分化をin vitroにおいて観察できる、これまでにない培養系となっている。実際、分化した味細胞は苦味物質や甘味物質に反応することも確認されている22)。味蕾オルガノイドは、2週間で幹細胞から成熟味細胞への変化を再現することができるため、どのような分子がどのタイミングで出現するかなどを調べることができる23)。また、味細胞の発生研究や再生医療のための研究はもちろん、5基本味に反応する味細胞としてアッセイなどに利用できる可能性がある。さらに、味蕾オルガノイドは、通常の株化細胞のように凍結保存が可能であり、外部からの遺伝子導入もできる利便性の高い細胞である。
図3 味蕾オルガノイドと消化管オルガノイド
図3:解説
図4 味蕾オルガノイドの作製法
図4:解説 6−2)げっ歯類から霊長類の研究へこれまで味覚研究には、様々なモデル動物が使われてきたが、最近は、遺伝学を使うことができるげっ歯類がよく用いられている。しかしながら、げっ歯類と我々ヒトなどの霊長類では、食性が違うため、ヒトの味覚研究のモデルとするには無理がある。実際、味覚受容体の数や特異性は、げっ歯類と霊長類では違うことが多い。例えば、苦味受容体の数は、ヒトでは26種類であるのに対し、マウスでは40種類も存在する24)。また、うま味受容体に反応するアミノ酸の数もマウスとヒトでは全く異なる25)。つまり、ヒトの苦味やうま味研究をする場合、げっ歯類はモデル動物としては最適ではないことになる。そこで我々は数年前から、京都大学霊長類研究所と共同研究体制を敷き、霊長類独特の味覚についてマウスと比較しながら研究している。現在までに、霊長類の味蕾オルガノイド作製に成功し、サル味蕾オルガノイドにおける遺伝子発現や呈味物質の応答などを調べている。 将来は、ヒトの味蕾オルガノイドを作製し、ヒトが口にする調味料や食品の開発に利用できればと考えている。新規呈味物質を発見または合成した際に、まずヒトが口にするのではなく、味蕾オルガノイドが最初に”味わう”日が訪れるかもしれない。また、味覚の感度が落ち、塩分濃度の高い食品を摂取しやすい高齢者に対する再生医療に、味蕾オルガノイドが利用される時が来るのではないかと考えている。高齢者では、髪の毛が抜け、傷が治りにくくなる。同様の現象が、高齢者の味細胞で起きていると予想され、味蕾の移植は味覚の健全化に貢献すると思われる。 6−3)シングルセル解析技術*(*注釈)どの分野の研究もそうであるように、新たな技術導入が新しい発見への近道となる。味覚研究の分野でも、ヒトゲノム計画により全ゲノムが解読され、受容体のクローニングに始まり様々な味覚関連分子が発見されその機能が明らかにされてきた。ゴールドラッシュのような20年が過ぎ去ろうとしているが、塩味受容の全容や、味幹細胞から最終分化にいたるまでの各ステップに必要な転写因子についての情報は不足している。この閉塞感を打開するための新しい技術として、Single Cell RNA-Seqを味覚研究分野にも導入したい。この技術は、文字通り1細胞が持つ遺伝子発現情報を網羅的に解析するものであり、細胞集団内の不均一性の把握、未分化細胞から成熟細胞への分化過程の可視化、集団内に存在するマイナー細胞群の発見などが可能となる。味覚研究では、これまでの研究では答えが明瞭ではなかった、甘味/うま味受容体の共発現細胞の有無、III型味細胞の神経伝達物質同定、高塩濃度に反応する塩味受容体候補のリスト化などが実現すると考える。また、ここでは書ききれないほどの恩恵が味覚研究者に与えられると考えられ、一刻も早く新技術を導入したいと考えている。 7)おわりにここまで、化学感覚の一つである味覚について最新の知見を紹介し、最後に課題を解決するための新技術についていくつか紹介した。これからは新技術により、これまでの味覚研究を再検証しつつ、新たな受容体や伝達物質を同定したい。次世代シークエンサーを使って遺伝子の網羅的解析が可能になったのはついこの前である。それにも関わらず、もう”次世代”という言葉が使えないほど技術革新の流れは早く、数年後にはシングルセル解析が当たり前になるだろう。その頃には、現在モヤモヤしている味覚研究も今よりずっとスッキリしたものになっているだろう。
*今や、NatureやScienceなどの一流誌では毎号のようにシングルセル解析のデータが掲載されており、日本でも急速にシングルセル解析の裾野は広がっている。先日も東京でシングルセルゲノミクス研究会(https://www.scg-j.net/)が開かれ大盛況であった。驚かされたのが参加者の年齢構成である。通常の学会では、様々な年齢層の研究者が見られるが、この学会の参加者は若者が大勢を占めた。新しい世界を若い研究者が作っていくのは頼もしく楽しみである。 参考論文
略歴
1994年名古屋大学農学部農芸化学科卒業 1999年東京大学大学院農学生命科学研究科博士課程終了 東京都臨床医学総合研究所,米国マウント・サイナイ医科大学,味の素(株)イノベーション研究所,東京大学を経て現在に至る。 日本味と匂学会研究奨励賞受賞(2013年) サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |