|
食科学研究とMALDI-MSおよびイメージング法の接点
九州大学 農学研究院生命機能科学部門 食品分析学研究室
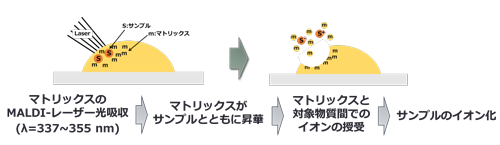
教授 松井利郎 1. はじめにMALDIとは「Matrix-Assisted Laser Desorption/Ionization」の頭文字をとった質量分析(MS)法でのイオン化法のひとつである。MS法では、測定対象となる分子種をイオン化させ、電場/磁場こう配下でイオン化分子を質量数の違いによって分離・検出する手法が基本であるため、MALDI法によるイオン化がすべてではない。たとえば、ガス状分子に対してはEI、CIなど、液状分子に対してはESI、APCI、固体状分子に対してはMALDI、DARTなどがあり、当然のことながら、イオン化法によって長所と短所がある。MALDI法も例外ではない(次項を参照)。MALDI法によるイオン化は、レーザー照射によって気相へと脱着(Laser Desorption)した分子種をマトリックス(Matrix)剤の支援(Assisted)によってイオン化(Ionization)させるものであり、概要は図1に示すとおりである。最大の特徴は、対象となる分子種のサイズを限定しないことである。要するに、イオン化可能な分子種を網羅的に検出できることから、多様なイオン化化合物情報を一度の測定で取得できる。2次元方向でレーザーを照射し、各照射スポットで得られた質量情報(mass to charge ratio, m/z)をマッピングすると、m/z毎の位置情報(分布性)が明らかとなる。この情報を色で識別すると、分布が可視化される。この解析手法をMALDI-MSイメージング法と呼んでいる。このように、MALDI-MSイメージング法は分析対象の分布性を静止画像として捉えることができる新しい分析法のひとつであるが、この単純作業(可視化)がどのような科学(特に本稿では食科学)の進展をもたらすのか、そのポテンシャル(期待感)を概説したい。 2. MALDI-MS法と食品分析MALDI-MS法は、測定物質とマトリックス剤で起こる主にH原子の引き抜き/付加反応によるソフトなイオン化法(図1)であるため、1価の分子イオンを生成しやすい。ただし、正イオンモードでの検出の場合、測定基材からの無機イオン付加によるNa+やK+等のイオン付加体形成に注意が必要である。また、分子量としては100万Da程度までの測定が可能である。したがって、これらの特徴を満たさない化合物はイオン化対象とはならない。具体的には、H原子の引き抜き/付加反応が容易な分子構造を持たない化合物のイオン化効率は総じて低い(検出感度が低い)。食品成分であれば、ポリフェノールなどの中性分子種の検出はMALDI法の苦手とする化合物である(第4項で再考)。また、イメージング法による組織切片での化合物の分布性を可視化する上で、マトリックス溶液の均一噴霧と組織表面での均一結晶化が困難な(不均一なマトリックス結晶が形成される)ことも問題となる。さらに、マトリックス剤そのものもMSによって検出されることから、マトリックスクラスターの形成によって500 Da程度以下の低分子分子種の特異的検出が困難な場合が多い(クラスターを含む多数のバックグランドノイズとのオーバーラップによる)。この点は、本稿の主題であるMALDI-MSイメージング法を食科学研究に展開する上で大きな障壁となる。いわゆる食品の代表成分であるアミノ酸、有機酸、核酸、ビタミン、カテキンに代表される低分子ポリフェノール、オリゴ糖、脂肪酸など、また生体調節作用が報告されているペプチドやポリフェノールなどはいずれもMALDI-MS法の苦手とする低分子量領域の範疇であり、MALDI-MS → イメージング(可視化)の技術が容易ではなく、食科学研究に対する本法の適用例が少ない要因のひとつと考えられる。
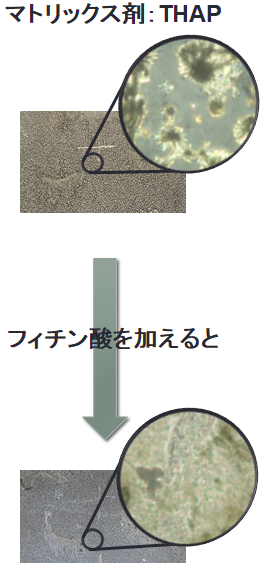
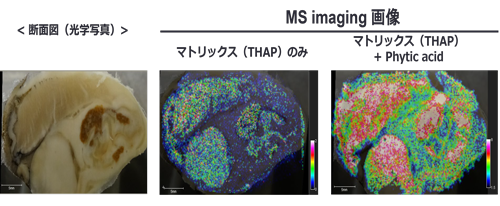
図1 MALDI法によるイオン化原理 3. マトリックス噴霧とMALDI-MS検出気相での測定対象化合物に対するプロトン受容体(あるいは供与体)として機能するマトリックス試薬は桂皮酸系をはじめ、これまでに多数の化合物が報告されている。測定試料とマトリックス試薬を混合し、専用プレートにスポットするMALDI-MS分析では、混合後に得られる結晶状態はさほどイオン化効率に影響を及ぼさない。他方、分布性解明を前提とするMALDI-MSイメージング法では、組織切片を酸化インジウムスズ(Indium Tin Oxide, ITO)コートされたスライドグラス上にマウントした後のマトリックス溶液の塗布は組織表面において均一である必要がある。市販のスプレーヤーを使用すると、マトリックス溶液の均一スプレーは可能であるが、組織表面で均一にマトリックス結晶が生成するとは限らない。図2はマトリックスとしてTHAP(2’,4’,6’-trihydroxyacetophenone)を噴霧したときに得られるITOスライドグラス表面のマトリックス結晶を観察したものである。明らかな島状結晶であり、仮にマトリックス結晶のない領域にレーザー照射されると化合物情報は得られず、低分解能かつ低感度のイメージング結果となってしまう。したがって、観測化合物の組織分布に関する解像度を高くするには、形成されるマトリックス結晶の均一化、すなわち一定速度での溶媒揮発となるような補助剤の添加が有効と考えられる。筆者らは、これに見合う補助剤として、分子内に6つのリン酸基を有するフィチン酸を見出している1)。フィチン酸添加は結晶の均一化だけでなく、キレート効果によるNa+やK+との付加イオン体の形成を抑えるため、結果として検出感度の向上にも寄与していることがわかる(図2および図3)。
図2 ITOスライドグラス表面でのマトリックス結晶
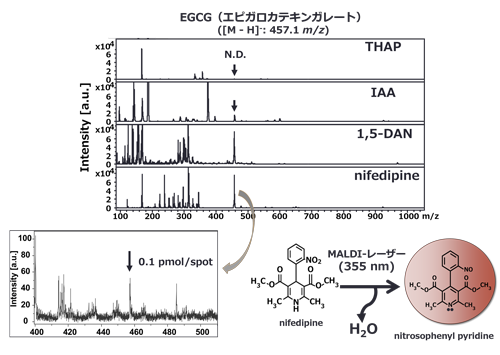
図3 牡蠣(タウリン)のMALDI-MSイメージング 4. 中性分子種(ポリフェノール類)のMALDIイオン化これまで述べてきたように、マトリックス支援によるイオン化では、たとえばカルボキシ基やアミノ基、リン酸基などイオン解離性官能基を有する化合物のイオン化を得意としているが、特徴的な官能基を持たない中性分子種のイオン化は不得意とする。ポリフェノールなどの中性分子種である食品成分には生体調節機能があることが知られ、ヒト試験での効果発現を前提とする消費者庁認可特定保健用食品(トクホ)についてもモノグルコシルヘスペリジン(血圧が高めの方の食品)や高分子紅茶ポリフェノール(血中中性脂肪が気になる方の食品)などのポリフェノール類が関与成分として利用されている。LC-MS分析法は生理作用を示すポリフェノール類の生体内利用効率を明らかにするために利用される2,3)が、ポリフェノールの組織局在性を明らかにするためのMALDI-MSイメージング分析法の活用例は上記理由により僅かである。負イオンモードでのポリフェノールのMALDI-MS分析には当該化合物よりH原子の引き抜き([M-H]-)が有効である。これまでの報告では、IAA(trans-3-indoleacrylic acid)4)やDAN(1,5-diaminonaphthalene)5)に引き抜き効果があり、ポリフェノール検出に有効であることが報告されている。図4に示したように、正イオン化を得意とするTHAPではEGCG(エピガロカテキンガレート、[M-H]-: 457.1 m/z)は検出されないのに対して、IAAやDANでは明らかな分子のイオン化が起こっていることが分かる。さらに、筆者らはnifedipine (2,6-dimethyl-3.5-dicarbomethoxy-4-(2-nitrophenyl)-1,4-dihydropyridine)に同様のH引き抜き作用があり、その効果(MS検出力)はDANよりも10倍以上高いことを明らかにしている(EGCG検出の場合、>0.1 pmol/spot)6)。また、nifedipineはフラボン、フラボノ—ル、フラバノン、フラボノン類など、多様なポリフェノール類に対してMALDI-MS検出が可能である6)。この広汎なポリフェノールイオン化特性はnifedipine分子がN2レーザー光(350 nm付近)を吸収可能なUV吸収帯を持っていること、この波長励起によってnifedipineはH原子引き抜き可能なnitrosophenyl piridine中間体となるためであると推察している(図4)。
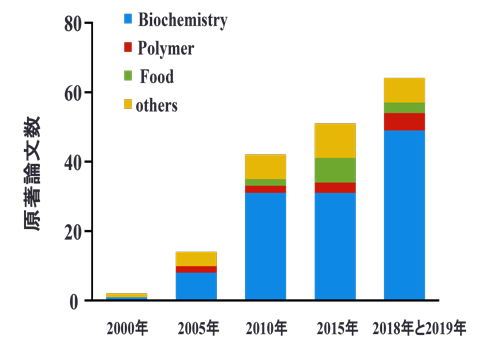
図4 EGCG(20 pmol/spot)のMALDI-MS検出 5. MALDI-MSイメージング法による可視化本法は対象切片(臓器や食品素材など)をマウントしたITOスライドグラスに対してN2レーザーを照射し、各レーザー照射位置で得られたMS情報のひとつを2次元的にマッピングした画像解析法である。したがって、本法の苦手とする化合物や測定条件等は前述したとおりである。さらに、イメージング法で注意すべき点は、1)2次元マッピング画像の解像度(空間分解能)はレーザーショット間距離に依存すること(数十μm)、2)破壊分析であるため、画像再現性は評価できないこと、3)測定した試料切片での検出強度の違いは分布量を反映するが、異なる切片間での量的な比較は困難であること、が挙げられる。しかしながら、本法は低分子のものから高分子まで抗体などを使用することなく多様な化合物の分布を一斉に解析できることから、これまでの可視化法を凌駕する極めてパワフルな研究手法であることは間違いない。図5に示したように、MALDI-MSイメージング法を用いた研究に関する原著論文数は増加傾向であり、その大部分は薬剤や生体成分、バイオマーカーなどの可視化に関する研究である。これは、本法が視覚的な学術情報を網羅的かつ簡便に与えることのできる可視化法のためであると考えられる。残念ながら、食科学に関する報告は僅かであり、今後の展開が待たれる。一方、研究者はこれまで述べてきた本法の特性を十分に理解することが重要である。再述するが、本法は分離を伴わず、m/zシグナルを単にイメージング処理した情報であるため、m/z値のみでは目的とする分子イオンを検出しているとは限らない。客観性、信頼性のある情報を得るには、やはり他の分析法の併用も重要であることはいうまでもない。
図5 MALDI-MSイメージング法に関する論文数の推移 6. 今後食科学への展開性については課題も山積である。食品素材の水分量、濃度、さらには可視化する意義を勘案し、課題解決のためのMALDI-MSイメージング法の利用を考えることが必要である。多成分混合系での食品成分の体内吸収動態、臓器移行や蓄積部位を可視化し、体内利用可能成分を判別する手法として活用するなど7,8)、新たな食科学的視点からの展開を期待したい。 参考文献
略歴
松井利郎(まつい としろう) サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |