|
食品の色と機能
東京農業大学 応用生物科学部
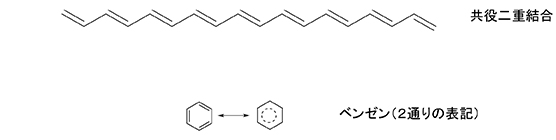
教授 中山 勉 はじめに食品は様々な色を呈しており、人類はその色を見て、衛生状態、風味、栄養価値、さらに最近では機能性などを想像・予見してきた。もともと「食品として好まれる色」には何等かの科学的根拠があるに違いない。本稿では植物性食品の色の特徴とその機能性について、いくつかトピックを紹介したい。さらに茶の色、特に紅茶の赤色色素であるテアフラビン類について、その生成機構、期待されている機能、作用機構の特徴などに関する最新の知見を紹介したい。 1.色とは何かヒトは380~780 nmの波長を示す電磁波を視覚として感じることができ、これを可視光と呼んでいる。視覚として感じることができる波長領域は動物によって異なり、白黒の判断しかできない種や紫外線領域まで認識できる種もある。そもそも、この可視領域が視覚の対象として定着したのは、遺伝子傷害を起こす紫外線や、熱の媒体である赤外線を避けてきたためとも考えられ、進化論的観点からの解明に興味が持たれる。ヒトの眼の網膜の視細胞中には3種類の錐体があり、異なった波長領域の可視光を、それぞれ青、緑、赤として感じる。光は物体にあたった時、その物体の表面で反射するか、吸収されるか、透過されるかのいずれかの形をとる。3種類の錐体に対応した可視光が、同時に、しかも適当な割合で刺激された場合に白色となり、互いに補色関係にある光が3種類の錐体を同時に刺激しても白色となる。したがって、白色光を構成する一部の波長領域が物質に吸収された場合、その補色が物質の色として認識される。可視光領域で吸収される生体物質(有機化合物)の発色団(chromophore)は、二重結合が一つおきに存在する共役(きょうやく)系を持つ原子団である場合が多い(図1)。共役二重結合を持つ物質は二重結合の間の単結合も二重結合のような性質を示し、分子全体にπ電子が広がった構造式(例えばベンゼンなど)で表すこともできる。その結果、紫外領域から可視領域にわたる光を吸収し、物質ごとに特徴的な色を呈することに加えて、脂溶性が高いことが多い。
図1.共役二重結合
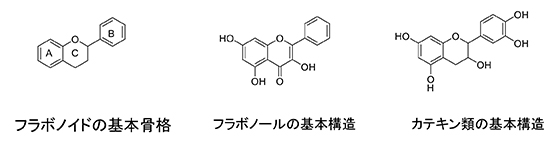
2.植物性色素a. クロロフィル(葉緑素)とカロテノイド多くの高等植物は、特に葉において、光合成反応を行うため緑色のクロロフィルを有している。クロロフィルは4分子のピロールが環状につながったポルフィリン系色素の一種であり、ポルフィリン環の中心にマグネシウムが配位した金属錯体であると同時に、ポルフィリン環全体が共役系で結ばれている。クロロフィル自体に顕著な機能性は認められていないが、近くにカロテノイドが同時に存在することが多く、“緑黄色野菜”の栄養機能や健康機能は主に、カロテノイドに由来すると考えられている。 カロテノイドは植物の葉緑体、根、果実などに存在しており、分子内に多数の共役二重結合を有している。この長い共役系の存在が可視領域において光を吸収する発色団となり、その結果、橙色や赤色を示し、脂溶性も高い原因になっている。にんじんに含まれるβ-カロテンやトマトに含まれるリコピンは代表的なカロテノイドである。β-カロテンはβ-イオノンに由来する構造を有し、摂取後、体内でビタミンAに代謝されるため、プロビタミンAと呼ばれる。一方、リコピンはβ-イオノン構造を持たないため、体内でビタミンAには変換されない。他のカロテノイドも同様にβ-イオノン構造の有無からビタミンA効力の予想がつく。温州みかんに含まれるβ-クリプトキサンチンはβ-イオノン構造を有するため、ビタミンA効力を持つ上に、様々な機能性が報告されている。みかんを食べすぎると皮膚が黄色くなるのはこの物質に由来すると言われている。 b. フラボノイドフラボノイド類の基本構造を図2に示す。フラボノイドは6員環(A環)-3員環(C環)-6員環(B環)の基本骨格に複数の水酸基が付いた構造を共通に持つ。フラボノイドはさらにフラボノールやカテキン類などのサブグループに分類され、サブグループごとに特徴的な色を呈する。まずケルセチンなどのフラボノールはすべての環に渡って、共役系が広がっているために、一般的に黄色を呈している。また、B環とC環をつなぐ結合は共役系により、純粋な単結合ではないため、分子全体が平面構造をとっており、脂溶性が高い原因になっている。フラボノール類は摂取されると、この高い脂溶性を弱めて尿中に排泄される必要があるため、血中ではグルクロン酸や硫酸抱合体として存在することが多い。カテキン類はA環とB環がベンゼン環であるものの、C環そのものに二重結合はなく、共役系は分子全体に広がっていない。したがってカテキン類の水溶液に色はついていない。また、B環とC環をつなぐ結合は単結合であり、A環とC環がなす一つの平面に対して、B環が回転していると考えられる。B環にはフェノール性水酸基が二つないし三つあるので、結果としてB環全体が嵩高い親水領域となり、緑茶成分としてのカテキン類の水溶性に寄与していると考えられる。しそ、なす、赤かぶ、ぶどう、いちごなどに含まれる水溶性のアントシアニン類は鮮やかな赤色や紫色を示す。これらの色素は、その色調がpHによって大きく変わることが特徴である。その理由は、アントシアニン類は中性でC環に+の電荷を持ち、pHの変化によって、電荷や二重結合の位置が変わるためである。 最近、赤い小豆の色素の構造が、アントシアニンの一種であるアントシアニジンとカテキンが縮合したカテキノピラジンAおよびBであることが報告された。カテキノピラジンそのものは、アントシアニン類と違って構造式の中に電荷を持たないため、pHを変化させてもほとんど色調が変化せず、餡の安定した紫色がこの色素に由来することが証明された1,2)。
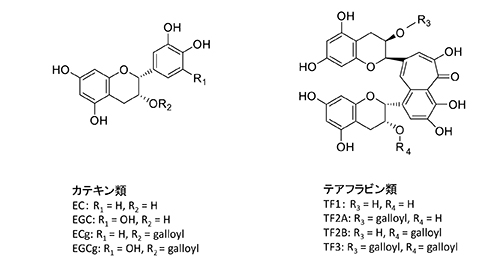
図2.フラボノイド類の基本構造
c. クルクミンカレー粉の多くにはショウガ科うこんを原料としたターメリックが含まれており、その成分であるクルクミンはカレー粉の黄色の主体をなしている。クルクミンは分子全体に共役系が広がっている物質であり、その機能性をうたったドリンク剤が販売されている。先ほどみかんを食べすぎると皮膚が黄色くなると述べたが、カレーを食べすぎたり、うこんを含むドリンク剤を飲みすぎたりして、皮膚が黄色くなったという話は聞いたことがない。その理由は、クルクミンは摂取後体内でその二重結合がすみやかに還元され、無色のテトラヒドロクルクミンをはじめとする低分子に代謝されるためである。 d. 果物の色果実類は、動物にそのまま食べられることを目的に発達した植物の組織であり、食べられやすくするためにも水分含量が高く、甘みや酸味、さらにフレーバー成分の含量が高いことが特徴である。果物の色は「食べごろ」を示すサインとして重要であり、アントシアニン類、カロテノイド、フラボノイドなどの含量が高まる。一方、クロロフィルは未熟果実に多く含まれるが、熟すにつれて減少する。この現象はアントシアニン類やカロテノイドの色調を際立たせるための役割とも考えられる。 3.茶の色飲料としての茶の色を「茶の水色(すいしょく)」という(「みずいろ」と発音すると空色(sky blue)の意味になる)。日本語の「茶色」は英語のbrownを意味し、ウーロン茶やほうじ茶の色である。「茶色」は複数の色素が混じっていることを反映し、単一構造をとる単一物質由来の色ではない。したがって、ウーロン茶とほうじ茶の成分は非常に複雑である。さて、日本語で茶と言えば普通「緑茶」を示し、紅茶にはわざわざ「紅」をつける。一方、欧米でteaと言えば普通「紅茶」を示し、緑茶の場合はgreen teaと言う。紅茶をblack teaという場合もあるが、中国の「黒茶」は、完成した茶葉に微生物を植え付け発酵させたものであり、英語では「黒茶」のことをdark teaと言う。 中国では茶を、白茶、黄茶、緑茶、青茶、紅茶、黒茶などに分類する。このうち、緑茶と紅茶は日本語の緑茶と紅茶にほぼ対応している。緑茶の緑色はそこに含まれるクロロフィルに由来するが、それが極端に少ないものを白茶と呼ぶ。これは希少価値のある栽培種として重宝され、色が薄いのにもかかわらず独特の風味を持つことから、高い値段で取引されている。日本の玉露は葉を摘む前に覆いをかぶせるが、この方法では葉のクロロフィルはむしろ増加するので、白茶にはならない。ウーロン茶は加工段階で茶葉が濃い青緑色を示すため、中国の分類では青茶に分類される。 茶を、不発酵茶、半発酵茶、発酵茶、後発酵茶に分類することもある。酒の醸造や納豆の製造など、通常の「発酵」過程では、微生物(厳密に言えば微生物の酵素)の働きで成分の化学的変化が起きる。それに対して、発酵茶(紅茶)の場合は微生物の関与はなく、茶自身が持つ酵素(ポリフェノールオキシダーゼ)の働きで、緑茶の成分であるカテキン類が2分子縮合する反応により、テアフラビン類という赤色色素が生成する。緑茶の製造過程では、葉をつみとった後すぐに、茶葉を蒸す過程があり、これによってポリフェノールオキシダーゼを含む多くの酵素が不活性化される。この過程を「殺青(さっせい)」と呼んでいる。ウーロン茶(青茶)は紅茶と緑茶の中間に位置づけられ、半発酵茶と呼ばれる。一方、茶葉に微生物を植え付け発酵させた黒茶は後発酵茶に分類され、プーアル茶がこれに相当する。黄茶は軽度の後発酵をしたものである。 4.紅茶の色素人類にとって、水分や飲料の摂取量としては水そのもの(生水とわかした水)が一番多く、次に茶(緑茶、紅茶、茶飲料など)が続く。紅茶だけを単独の項目として切り離しても、その摂取量(L:リットル)は水に続いており、アルコール飲料やコーヒーよりも多い(ただしコーヒー豆や茶葉など、原料の乾燥重量(t:トン)どうしで比較するとコーヒーの方が多い)。これだけ多く飲まれている紅茶であるが、その機能性に関する学術論文の数は緑茶に比べると少ない。人類の歴史において、茶やコーヒーの飲用がさかんな一番の理由は含まれるカフェインによると考えられるが、カフェインに関する研究は緑茶やコーヒーの摂取を念頭においたものが多い。カフェインにつぐ紅茶の機能成分としてカテキン類が挙げられるが、こちらも緑茶を念頭に置いた研究が中心であり、紅茶独自のものは少ない。紅茶を特徴づけるその紅い色は、ポリフェノールオキシダーゼが関与するカテキン類の酸化的縮合反応により生成するテアフラビン類やテアルビジン類に由来する。テアフラビン類はカテキン類の縮合反応により生成するのに対してテアルビジン類はテアフラビン類よりも複雑に酸化、重合した物質群として考えられており、単一物質として単離精製・構造決定されたものは存在しない。しかし、その総量はテアフラビン類よりも多く、紅茶の機能性への寄与を無視することはできない。 テアフラビン類は、茶葉に含まれるポリフェノールオキシダーゼによるカテキン類二分子の縮合反応により生成するため、その化学構造は出発物質のカテキン類の組み合わせから一義的に決まる。ここで重要なのは、テアフラビン類は必ずカテコール型のカテキン類(ECとECg)とピロガロール型のカテキン類(EGCとEGCg)の一分子ずつの組み合わせから生成し、ピロガロール環はテアフラビン類のベンゾトロポロン環のトロポロン環(7員環)に、カテコール環はベンゾトロポロン環のベンゼン環に移行することである(図3)(表1)。ベンゾトロポロン環は共役系で構成されており、赤い色の発色団である。テアフラビン類はカテキン類あるいはテアルビジンと作用機構の共通性が示唆されている。カテキン類に関しては、脂質二重膜やたんぱく質の疎水領域への作用が多く報告されてきた。特にガロイル基を有するECgとEGCgがそれらを有しないECとEGCに比べて活性が高いのは、この疎水性あるいはリン脂質に対する親和性の差が寄与していると考えらえる。なお、テアフラビン類はカテキン類に比べて、疎水性とリン脂質に対する親和性はかなり高い。
図3.茶カテキン類と紅茶テアフラビン類の基本構造
テアフラビン類の腸管から血中への吸収を示す論文は報告されておらず、テアフラビン類は典型的な難吸収性ポリフェノールの一つであると考えられる3)。精製したテアフラビン類を用いたさまざまな生理機能が報告されるようになった。以下に紹介する論文は、すべてテアフラビン類の腸管からの吸収を考えなくても説明できるものばかりである。たとえば,苦味4)、渋味5)、抗菌性6)、インフルエンザウイルス不活化7)などがある。これらはカテキン類にも認められる作用であるが、in vitro試験においてその強度はカテキン類よりも高いとされている。したがって緑茶より紅茶の方がこれらの効果は強いと期待される。また、in vivo試験においては経口投与による血流促進やエネルギー消費の促進8, 9)などの報告がなされている。これらの結果に基づいて、「難吸収性ポリフェノール類が摂取直後から循環器系・代謝系に変化を与えることから、ポリフェノールの一部は消化管に存在する知覚神経に認識され、その結果として交換神経を刺激する」メカニズムが提唱されている3)。 紅茶の摂取が血中の総コレステロールやLDL コレステロール濃度を減少させることが、ヒト研究やメタアナリシスで報告されており10, 11)、さらにin vivo 試験やin vitro モデル実験において、テアフラビン類が胆汁酸ミセルにおけるコレステロールの溶解性(取り込み量)を低下させることが報告されている12, 13)。最近、我々はテアフラビン類の中でも特にTF2Aがリン脂質二重層や胆汁酸ミセルの凝集・沈殿を起こすことを見出した14)。これはテアフラビン類が舌、腸管上皮細胞の細胞膜、腸管内に存在する胆汁酸ミセルなどにおいて、リン脂質との分子間相互作用を起こす可能性が高いことを示している。ただし、逆相HPLCの保持時間はTF1<TF2A<TF2B=TF3の順に長くなることが多く、in vitro実験や、in vivo試験によっては、TF2Bの活性がTF2Aよりも高い場合もある。したがって必ずしも疎水性の大小やテアフラビン類とリン脂質だけの分子間相互作用の強弱だけですべての構造活性相関や作用機構を説明できる訳ではない。今後、個々の機能について分子レベルでの作用機構の解析が必要である。
表1
略歴
中山 勉(なかやま つとむ)
サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
||||||||||||||||||||||
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |