|
食品因子の組み合わせによる生理機能の増強
神戸大学大学院農学研究科
教授 水野 雅史 株式会社伊藤園 中央研究所 参与 坂根 巌 はじめに食品は口から摂取された後、胃を経由して腸に至るわけだが、食品中の機能性分子(食品因子とも言われる)がその名の通り生体調節機能を発揮するためには、主に腸管を介して吸収された後に標的となる組織あるいは細胞で働く必要がある。多くの場合、機能性分子は吸収および運搬の過程で代謝修飾を受けてから標的細胞で効能を発揮するに至るはずである。この腸管は食物を消化および吸収する場であるとともに、異物認識に代表される免疫応答を担う生体防御器官としても重要な役割を担っている。しかしながら、腸管そのものは複数の特化された細胞種が階層をなす器官であり、機能的にも複雑過ぎる。従って、実際に動物実験によってある発症モデルを開発したとしても、免疫応答を始めとして制御機構を解明するのは難しい。この問題点を解決する目的で、小腸上皮様培養細胞(Caco-2細胞)とマクロファージ様培養細胞(RAW264.7細胞)をトランズウェル膜で隔てることで炎症性腸疾患を反映した共培養系モデル1)、およびCaco-2細胞と肥満細胞様培養細胞(RBL-2H3細胞)をトランズウェル膜で隔てることでアレルギー発症を反映した共培養系モデル2)を構築してきた(図1)。これらの共培養系を用いて、それぞれの疾患に対して抑制効果を示す可能性のある食品因子として、炎症性腸疾患に関してはシイタケに含まれている免疫賦活化多糖としてよく知られているレンチナン3)やセロリ、ピーマン、シソなどに多く含まれているルテオリン4)が、アレルギーに関しては炎症性腸疾患モデルでも抑制効果を示したルテオリンに加えてブロッコリー、キャベツ、タマネギに多く含まれているケンフェロール5)などが見出された(図2)。しかしながら実際の食事では、食品因子は多種多様な成分と共存することが多い。つまり各成分との組み合わせが実際の生理活性を評価する上では重要であると考えられる。 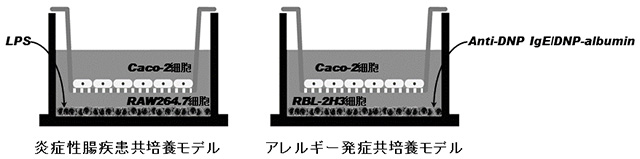
図1.炎症性腸疾患共培養系モデルおよびアレルギー発症共培養系モデルの概略図 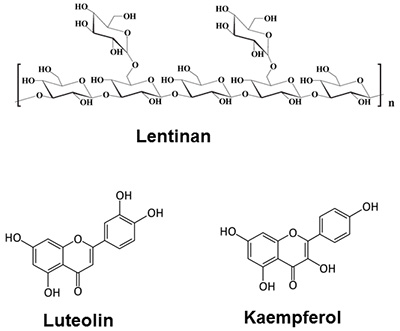
図2.レンチナン、ルテオリン、ケンフェロールの構造 2.炎症性腸疾患モデルにおける食品因子の組み合わせによる影響ポリフェノールは様々な生理機能を有する成分として知られている。一方、ポリフェノールは小腸で速やかに吸収されるが、小腸上皮細胞内のUDP-グルクロン酸転移酵素(UGT)や硫酸転移酵素(SULT)といった抱合酵素により抱合されるため、アグリコンとしての吸収量は少ない。我々の研究室では、インビトロおよびインビボにおいてポリフェノールの一種であるルテオリンの腸管炎症抑制効果を明らかにした4)。またその抑制機構は、腸管上皮細胞から吸収されるルテオリンそのものの量に依存していることを炎症性腸疾患モデルの結果から明らかにした。実際100 μMのルテオリンを管腔側から添加すると、基底膜側に透過するルテオリンそのものは約4 μM程度しか存在していなかった(図3)。このようにいくら抗炎症効果が期待できても、ルテオリンそのものの吸収量は非常に低いことが大きな問題点である。そこで、ルテオリンの吸収量を増加させ、ルテオリンの腸管炎症抑制効果を亢進する物質を探索した。具体的には、Caco-2細胞を播種したトランズウェルの管腔側に、ルテオリンと供試物質の混合液を添加した。6時間後、管腔側と基底膜側の培地および細胞内のルテオリン量をHPLCにより定量した。基底膜側へのルテオリンの透過量を増加させた化合物に関して、Caco-2/RAW264.7細胞の炎症性腸疾患モデルを用いて、ルテオリンの抗炎症効果に対する影響を評価した。混合液を管腔側に供し、3時間培養後に基底膜側のRAW264.7細胞をLPS刺激し炎症状態を誘発した。さらに3時間培養後、基底膜側の上清を回収し、killing assayでTNF-α産生量を測定した。また、Caco-2細胞から全RNAを抽出し、real-time PCR法によりIL-8 mRNA発現量を測定した。その結果、Caco-2細胞を用いたルテオリン透過試験において、ルテオリン単独添加(15 nmole)の場合と比較して、ケルセチン、ケンフェロール、ガランギンをそれぞれ15 nmole同時添加した場合、基底膜側へのルテオリン透過量が増加したが、クリスチン(15 nmole)だけはその効果は認められなかった6)(図4)。この結果をもとに、さらに炎症性腸疾患モデルを用いて抗炎症効果を調べた。ルテオリン単独では抑制効果を示さない濃度(15 nmole)に対して、管腔側からケルセチン、ケンフェロール、ガランギンを等濃度で同時に添加すると、ケルセチンとケンフェロールではTNF-α産生量に対して有意な抑制効果が確認できた。さらにCaco-2細胞におけるIL-8 mRNA発現量に関しても同様の結果であった。この内ケルセチンは、柑橘類、タマネギ、ソバなどの多くの植物に含まれており、機能性成分としても注目されているポリフェノール類の一種である。そこでルテオリンとケルセチンの濃度比がルテオリンのCaco-2細胞基底膜側への透過率に及ぼす影響について検討した。炎症性腸疾患モデルの管腔側からルテオリンとケルセチンを所定濃度添加した後、6時間後に基底膜側に透過してきたルテオリンそのものの量をHPLCで測定した。図5に示す通り、興味深いことに両ポリフェノール濃度が等モルの時にのみ、Caco-2細胞を介した基底膜側へのルテオリンの透過率は有意に向上し、その割合は管腔側に添加したルテオリン量の約50%であった。一方、ケルセチン量に対してモル比で半分あるいは倍添加しても、その透過率に変化は認められず、ルテオリンのみを添加した量とほぼ同じであった。 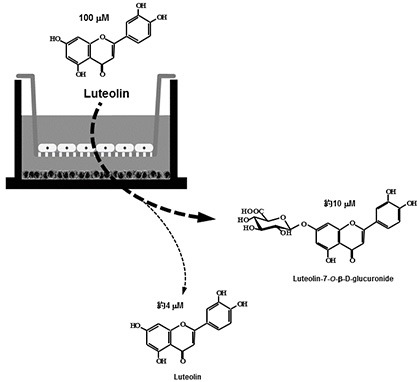
図3.炎症性腸疾患共培養系モデルにおけるルテオリンおよびその代謝物の透過性 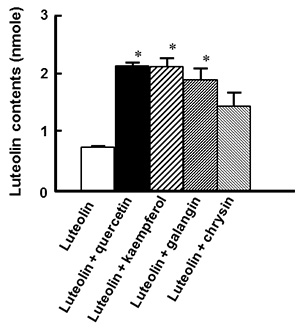
図4.ルテオリンとポリフェノールの組み合わせによる基底膜側へのルテオリンの透過量の変化 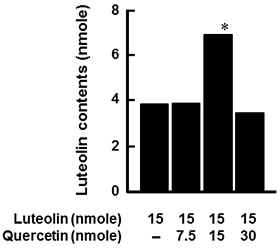
図5.ルテオリンとケルセチンそれぞれのモル比の違いによる基底膜側へのルテオリンの透過量の変化 3.アレルギー発症モデルにおけるルテオリンとケルセチンの組み合わせによる抗アレルギー効果炎症性腸疾患モデルを用いた実験からルテオリンとケルセチンを組み合わせることで基底膜側へのルテオリン透過率が向上すること、またそれはそれぞれが等モルである必要があることが明らかとなった。一方、ルテオリンは肥満細胞からのヒスタミンとβ-hexosaminidaseの放出を阻害する因子として知られている7)。従ってルテオリンとケルセチンの組み合わせによって、肥満細胞の脱顆粒が抑えられることが予測された。そこで、抗アレルギー効果を持つ食品因子を探索するために開発したアレルギー発症モデルを用いて、両ポリフェノールの組み合わせによる影響を検討した。アレルギー抑制効果の指標には、RBL-2H3細胞から基底膜側の上清に放出されたβ-hexosaminidase活性を測定し脱顆粒の指標とした。あらかじめRBL-2H3細胞を12穴プレートに播種し3時間インキュベート後、抗DNP-IgEを添加して一晩培養した。このようにして感作させたRBL-2H3細胞とCaco-2細胞からなる共培養モデルの管腔側に、ルテオリン単独あるいはルテオリンとケルセチンの混合液を添加し6時間インキュベートした。その後、脱顆粒を惹起するため、基底膜側にDNP-albumin(抗原)を添加し10分間反応させ、培地中のβ-hexosaminidase活性を測定した。50 nmoleのルテオリンを管腔側に添加するとβ-hexosaminidase活性は、抗原によって脱顆粒を惹起させた区(IgE/Antigen)に比べて約80%まで有意に抑制された(図6)。図5の結果からルテオリンとケルセチンを等モル添加すると基底膜側にはルテオリン単独添加した時の二倍量透過させることが予測されたので、25 nmoleのルテオリンあるいはケルセチンをそれぞれ単独か同時に添加してβ-hexosaminidase活性を測定すると、両ポリフェノール単独処理区では抑制効果は認められなかった。しかしながらルテオリンとケルセチンを同時に添加した区では、予測した通り有意な抑制効果が認められその程度はほぼ50 nmoleルテオリン処理区と同等であった。これらの結果から、Caco-2/RBL-2H3共培養系においてルテオリンとケルセチンを等濃度摂取することで、ルテオリンの基底膜側への透過率が向上し、その結果RBL-2H3細胞の脱顆粒が抑制されることが推察された。 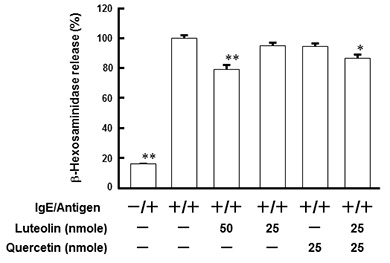
図6.ルテオリンとケルセチンの組み合わせによる抗アレルギー効果の増強 4.他の食品因子との組み合わせによるアレルギー抑制効果ルテオリンの生理機能は、ポリフェノール類と組み合わせることで増強されることが示唆された。そこでほかの食品成分についても同様のことがみられるかを検討した。特に腸内細菌として注目されている乳酸菌との組み合わせについて検討した。我々の研究室では、既にEnterococcus faecalis IC-1株がインビトロにおいてもインビボにおいても抗アレルギー効果を示すことを報告してきた2)。そこでこのIC-1株とルテオリンの組み合わせによる効果を受動的アナフラキシー(PCA)反応を用いて検討した。メス8週齢BALB/cマウスに200 mgルテオリンと1.0×108 cfu/mouse/dayのIC-1株をそれぞれ単独あるいは同時に経口投与を10日間連続で行った。投与最終日にイソフルラン麻酔下で両耳介に10 µg/mlの抗DNP-IgEを10 µlずつ皮内投与し、その24時間後、抗原であるDNP-BSA溶液(2 mg/ml)に10 mg エバンスブルー色素を混合した溶液を100 µl尾静脈投与した。30分反応後、両耳介を回収し、3N KOH(250 µl)中に浸漬し、37℃で一晩振とうすることで組織を溶解させた。続いて、エバンスブルー抽出液(0.6 N H3PO4:(CH3)2CO=5:13混合液)を225 µl添加し、遠心分離後の上清の波長620 nmにおける吸光度を測定した。図7に示した通り、アレルギー反応を惹起したIgE/Antigen区では、耳介へのエバンスブルー漏出がコントロール区に比べて有意に増大した。一方、ルテオリンとIC-1を組み合わせた区ではIgE/Antigen区に比べて約56%まで有意に抑制され、IC-1単独投与区に比べても強い抑制傾向がみられた。しかしながらルテオリン単独区に関しては、全く抑制効果は観察されなかった。このように、ルテオリンはそれ自体が抗アレルギーを示すばかりでなく、それ自体が活性を示さない低濃度であっても乳酸菌のような他の食品因子の抗アレルギー効果を増強することが分かった。この効果が相乗的なのか否かは、今後明らかにしていきたいと思っている。今回用いたIC-1は、ヒトの腸管細菌叢に広く生息する通性嫌気性グラム陽性球菌である8)。従って、ルテオリンを含む食品を選択的にとることは、アレルギー発症予防には有効な手段になり得るかもしれない。 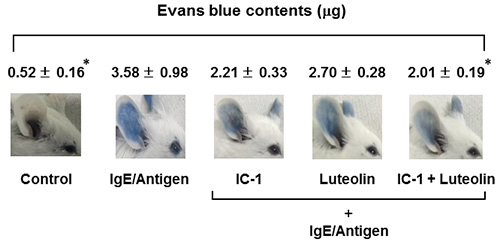
図7.受動的アナフラキシー反応におけるルテオリンとIC-1株との組み合わせによる抗アレルギー効果 5.おわりにこれまで食品因子の機能性については、単独の化合物に関して研究がなされてきたものがほとんどであった。しかしながら、今回の研究からもわかるように同時に摂取する成分によって活性物質の吸収率も変化するし、それに伴い本来持っている生理機能も変化する可能性が提起された。今回は、ルテオリンを中心にポリフェノール類との組み合わせによる抗炎症効果の増大、あるいは等モル比でルテオリンとケルセチンとの組み合わせのみが抗アレルギー効果が増強されることを中心に述べてきた。しかしながらここではデータを示さなかったが、ピペリンとルテオリンを同時にCaco-2/RBL-2H3共培養系の管腔側から添加すると、基底膜側のルテオリン濃度の低下およびルテオリン単独処理した際のβ-hexosaminidase活性と比較してその増大が観察されている。このように多種多様の成分を含んでいる食品をどのように組み合わせて摂取する、つまり「食べ合わせ」を考えることが、それぞれの食品因子が持つ機能性を有効に発揮させられるかどうかにかかっており、今後の重要な課題の一つだと思われる。 さらに、ポリフェノール類以外についても検討するため、腸内細菌としても存在していて、プロバイオティックスでもあるE. faecalis IC-1株8)との組み合わせについても検討した。このIC-1株は、腹腔内投与では抗アレルギー効果を示さず、経口投与でのみ効果を示すことがPCA反応で明らかになっている2)。また、各種Toll-like receptor(TLR)の中和抗体で前処理したCaco-2細胞を用いた共培養実験から、IC-1株はTLR2を介して認識される可能性が示唆された。これらのことを総合すると、ルテオリンによるIC-1株の抗アレルギー効果増大の要因を明らかにするためには、Caco-2細胞表面上のTLR2の発現が増大したのか、透過したルテオリンそのものが肥満細胞に作用しているのかを始め、まだまだ検討しないといけないことは山積みであり、さらなる研究を通じて抑制機構の解明を進めていきたい。 文献
略歴水野 雅史(みずの まさし)
坂根 巌(さかね いわお)
サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |

