|
沿岸(里海)環境からの乳酸菌および酵母の分離と応用
東京海洋大学 学術研究院 食品生産科学部門
准教授 久田 孝 1.はじめにわが国の長い海岸線には多種多様な景観が存在している。里海とは柳氏により「人手が加わることで生物多様性と生産性が高くなった沿岸海域」と定義され1)、環境省においても同様に提唱している。そこは、人と自然の領域の間にあるエリアで、里山と同じく人と自然が共生する場所であり、伝統的な漁業、社会組織、食文化が生まれ、伝承されてきた場所である。環境中に生息している微生物は、基本物資の循環に大きく貢献しており2,3)、その一部は水産物、発酵食品、残渣・廃液処理等を介して、人々の暮らしとかかわっている4-6)。スクリーニング時代とも呼ばれる20世紀前半から、抗生物質など医薬品候補物質産生菌、レンネットなど有用酵素産生菌、調味料に用いられるアミノ酸や核酸関連化合物などを産生する菌など、様々な環境由来の有用微生物の探索が行われてきた7)。現在でも国内外の多様な伝統的発酵食品や極限環境中からの微生物探索は精力的に行われており8-10)、それぞれの厳しい環境へ対応して進化したと考えられる遺伝子は、現在の様々な分野の工業製品、環境浄化、医療、研究に応用されている11-13)。筆者らの研究室では身近な沿岸域=里海環境を微生物の分離源とし、分離される乳酸菌および酵母のうち、人間にとって有用な機能を持つものを「里海乳酸菌・里海酵母」と位置づけ、まだ小規模であるが菌株の選抜・保存と、性状、発酵および機能性試験を行ってきた。本稿ではその内容のいくつかを紹介したい。 2.水産発酵食品由来乳酸菌2-1. ナレズシ系とイズシ系石毛およびラドルは「魚醤とナレズシの研究14)」において、モンスーン・アジア地域には魚と塩と米を用いた発酵食品、いわゆるナレズシ系の文化が水稲栽培とともに広がっていることを示しており、その文化は、日本でも古くは本州全域に広がっていたと考えられる。現在でもこのプロトタイプ(ナレズシ系)が近畿地方、特に琵琶湖周辺で伝承されているが(図1)、関東以北では麹によって発酵を早める、いわゆるイズシ系の傾向がある15)。北陸地域はその中間に位置し、ナレズシ系およびイズシ系の両方の食文化が残っている。 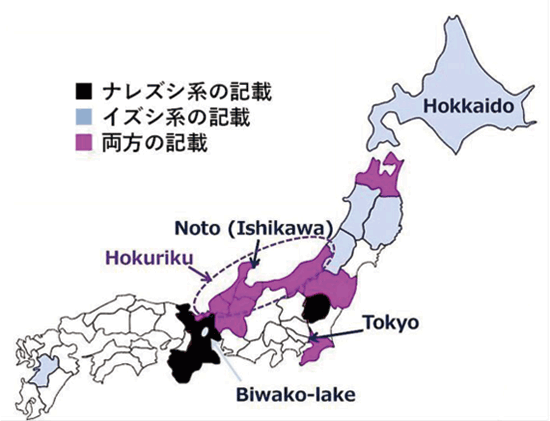 図1.ナレズシ系とイズシ系の分布「日本の食品事典」農文協より筆者らが作図15)。 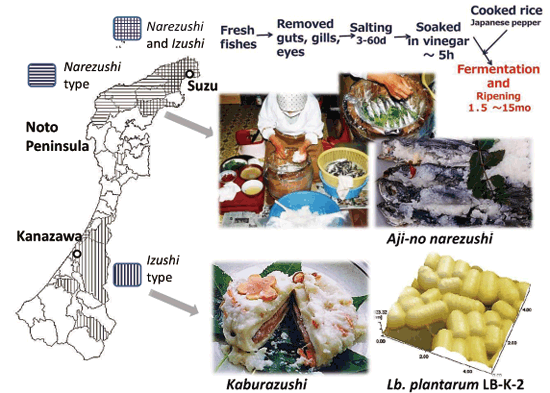 図2.加賀・能登のナレズシ系とイズシ系(かぶらずし、だいこんずし)の分布。各(旧)市町村史誌等より筆者らが作図15)。 2-2. ナレズシ乳酸菌能登において、古くは山間地区でウグイ、アユ、サケなど川魚のナレズシが作られてきたが、近年では川魚が獲れなくなったこともあり、マアジを材料にすることが多く、港周辺の町で多く作られている15)。製造法は各家庭、加工所で異なるが、おおむね、①鮮魚の鰓・内臓・眼球の除去、②塩蔵(塩分18-33%)、③酢漬け(数秒-5時間)、④本漬け(魚の半分-同量の米飯、図2)、⑤発酵・熟成(1.5か月から1年以上)という流れである。本漬け後すぐに乳酸菌が増加し8 log CFU/gになり、乳酸量も3%以上に達する典型的な乳酸発酵食品であるが、熟成1年を越したものでは生菌数は6 log CFU/gに減少する16)。 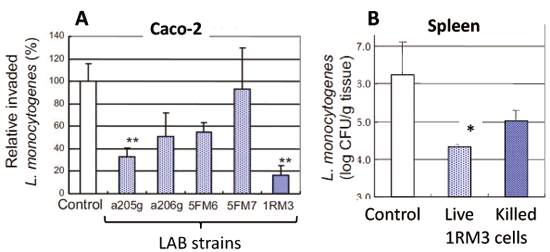 図3.あじのなれずし由来Leuconostoc mesenteroides 1RM3によるリステリア菌のヒト腸管上皮様Caco-2細胞(A)、およびA/Jマウス脾臓(B)への侵入の抑制19) *,** Controlと比較して有意差あり: * p < 0.05, ** p < 0.01。 2-3. かぶらずし乳酸菌かぶらずしは塩漬けしたブリの切り身を塩漬けしたカブに挟み込み麹とともに発酵させる加賀地区の伝統的な乳酸発酵食品で(図2)、冬(正月)のハレの食品でもある。また、だいこんずしは、より庶民的な食材のダイコンと身欠きにしんを用いて同様に漬け込んだものである。かぶらずし、だいこんずしとも、原料中には4 log CFU/g程度の雑菌が存在しているが、伝統的な方法で漬け込まれた場合、開始3日後には乳酸菌数が8 log CFU/g以上になり、漬け込み7日後には乳酸量は1%以上、pHは4.5以下に低下し、雑菌は検出されなくなる21)。しかし、お土産用に市販されている製品の乳酸含量はいずれも低く(0.5%未満)、その中には、乳酸菌数が5 log CFU/g以下、乳酸がほとんど含まれず、酢酸含量が高い乳酸発酵食品とはいえない製品もあった。 3.魚類腸管由来乳酸菌3-1.魚類腸管から分離される乳酸菌筆者らの経験では、魚類腸管内容物の乳酸菌数はそれほど高くはなかったが、通常のde Man, Rogosa and Sharpe(MRS)ブロスやGifu Anaerobic Medium(GAM)ブロスなどで増菌すると、Lactococcus属、Leuconostoc属などの乳酸球菌が分離され、酸性培地や胆汁添加培地を用いるとLb. plantarumなどの乳酸桿菌が分離された。例えば、北海道羅臼港で水揚げされたシロサケの腸内容物からLactococcus lactis、Ln. mesenteroidesが分離され、さらに性成熟が認められない鮭児(非常な高値がつく)からはVagococcus fluvialisが分離された23)。その分離菌の多くは、その標準菌株より高塩分、酸性、胆汁存在下での増殖能が高かった(図4)。また、通常の成魚と未成熟の個体で分離菌が異なることも興味深く、Vc. fluvialisは養殖魚へのプロバイオティクス効果の報告例もある24)。一方、三陸沿岸で水揚げされた魚介類の腸内容物を酸性培地、胆汁含有培地に加え増菌した場合には、ウミタナゴ、クロソイからLb. plantarumが、ゴマサバからPediococcus pentosaceusが分離された25)。 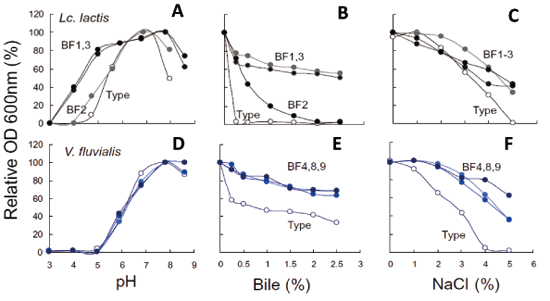 図4.シロサケ腸管分離Lactococcus lactis(BF1,2,3)、Vagococcus fluvialis(BF4, 8, 9)とその基準株(Type)の増殖におよぼすpH(A, D)、胆汁濃度(B, E)、および塩分(C, F)の影響23) 3-2.魚類腸管由来乳酸菌の機能性これらの魚類腸管由来株のうち、シロサケ由来Lc. lactis BF3、ゴマサバ由来Pc. pentosaceus Sanriku-SU6などいくつかの乳酸球菌株がRAW264.7細胞およびDSS誘導IBDモデルマウスにおいて抗炎症性を示した23,25,26)。一方、ウミタナゴ由来のLb. plantarum Sanriku-SU3はin vitroで胆汁酸(グリココール酸、タウロコール酸、デオキシコール酸)低減能を示し(図5)、高脂肪食マウスにおける肝臓中コレステロールの低下が示された27)。Sanriku-SU3の加熱死菌体はin vitroで生菌体よりも効果が高かったが、マウスにおいては生菌体の効果が高い傾向であった。 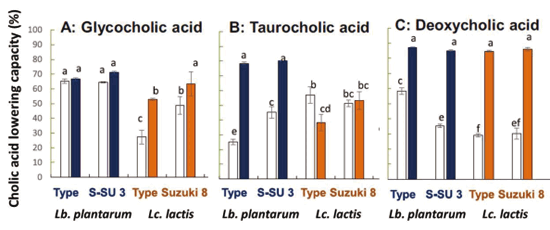 図5.魚類腸管由来乳酸菌(S-SU 3、Suzuki 8)およびその基準株(Type)のin vitroでの胆汁酸低減能27)。□:生菌、■:加熱死菌。a-f 異なる文字間で有意差あり(p < 0.05)。 3-3.p-ニトロフェノール低減能p-ニトロフェノール(PNP)は芳香族炭化水素で、かつては医薬品・農薬の重要な原料として使用されてきたが、環境汚染物質のひとつとされ、魚介類に対する毒性も報告されている。これまでに環境浄化に用いるため、工場廃液で汚染された土壌や河川などから芳香族炭化水素分解菌の探索がなされており、グラム陰性好気性細菌のPseudomonas syringaeや放線菌の仲間のArthrobacter aurescens、Rhodococcus opacusなどが報告されている28-30)。筆者らは海洋中に放出されたPNPは海洋動物の腸内細菌によっても分解されることを予想し、魚類の腸管内容物をPNP含有Brain Heart Infusion (BHI)ブロスに接種し、その低減能を確認した。その結果、漁獲域にかかわらずPNP低減が認められ、その培養液には予想外なことに乳酸球菌Lc. lactis subsp. lactisが増殖していた。その分離乳酸菌のPNP低減能は分離源や株によって大きく異なり、スズキ腸内容物由来Lc. lactis JS-1に明確なPNP低減能が認められた31)。 4.漂着海藻由来乳酸菌および酵母4-1. 海藻の発酵沿岸に漂着した海藻のうち利用可能なものは食用、肥料、飼料の他、建材(漆喰原料など)としても伝統的に使用されてきた32)。しかし、大潮やしけの後に大量の海藻が浜に漂着し(図6)、それが利用されないまま堆積した場合には、景観の悪化や臭気の発生が問題となるため、地元住民や行政によって焼却や埋設される。筆者らは、その漂着海藻を機能性食品素材として有効利用するため、ミネラルや多糖類の含量、抗酸化性などを検討してきた33)。近年ではさらに、機能性と食味の改善を目的に、海藻発酵が可能な乳酸菌および酵母の探索を行っている。  図6.石川県珠洲市(左)、千葉県銚子市(右)沿岸に打ちあげられ堆積した海藻。 4-2. 漂着海藻由来酵母の酒類醸造特性清酒は公益財団法人日本醸造協会が頒布しているきょうかい酵母を用いることにより、品質は安定している。一方、近年では清酒においても地域性や味の多様性が望まれ、各地の研究機関において、はなやかな風味をつくりだす酵母の育種や、地元ゆかりの花や果物からの天然酵母の探索が行われている。筆者らもこれまでに、石川県内の市町村の花からSaccharomyces cerevisiaeを分離し、そのうちのひとつは地元の酒米を地元の酒蔵で仕込んで醸造され、町おこしにも役立っている39,40)。 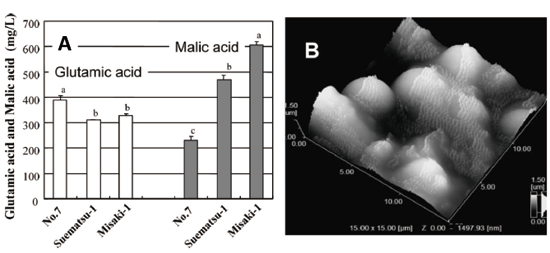 図7.清酒小仕込試験もろみ中のグルタミン酸Naおよびリンゴ酸濃度におよぼすS. cerevisiae菌株の影響(A)。S. cerevisiae Misaki-1株を用いたもろみの原子間力顕微鏡(AFM)観察像(B) 4-3. 漂着海藻由来乳酸菌・酵母で発酵した糠汁による魚臭抑制気仙沼港は日本一のサメ水揚げ量を誇り、フカヒレ、すり身の材料だけではなく、鮮度のよいものは刺身、また切り身の状態で販売されてきた。伝統的に食用とされてきたネズミザメおよびヨシキリザメの肉は、新鮮であれば臭気はなく上質な肉質であるが、アンモニアのイメージが強く、ヒレと比較して極端に低価格となっている。 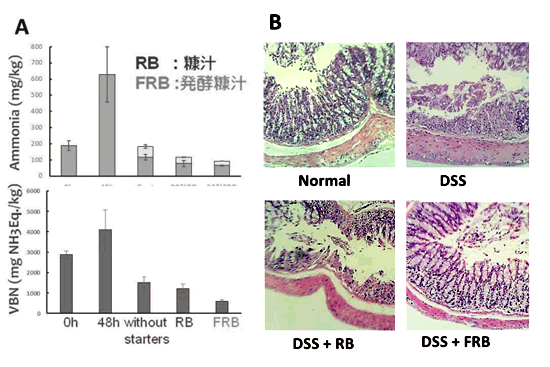 図8.三陸沿岸海藻由来乳酸菌Lb. plantarum Sanriku-SU8およびS.cerevisiae Misaki-1で発酵した糠汁(FRB)を用いた浸漬によるヨシキリザメ肉中のアンモニアおよび揮発性塩基窒素(VBN)の低減(A)41)。B:DSS誘導IBDモデルマウスにおけるFRBの炎症抑制効果(HE染色像)42)。 5.おわりに上記のように、これまでは系統的な研究とはいえないが、水産物の品質、機能性を付加するために微生物を探索してきた。分離・保存された菌株は耐塩性だけではなく、各種ストレス耐性が高いものがあり、現在は、保存菌株の中から免疫賦活、抗炎症性、胆汁酸低減能などを指標に再スクリーニングを行っている。今後、各菌株のゲノム情報による比較・整理が必須と考えている。 参考文献1) 柳哲雄(2013)里海の提唱・これまで・これから.日本水産学会誌 76:1025-1026. 2) Masse J, Prescott CE, Renaut S, Terrat Y.(2017)Plant community and nitrogen deposition as drivers of alpha and beta diversities of prokaryotes in reconstructed oil sand soils and natural boreal forest soils. Appl Environ Microbiol 83:e03319-16. 3) Dang H, Lovell CR.(2017)Microbial surface colonization and biofilm development in marine environments. Microbiol Mol Biol Rev 80:91-138. 4) Kuda T.(2015)Quality improvement and fermentation control in fish products, p.377-390, Advances in Fermented Foods and Beverages, Holzapfel Ed., Woodhead Publishing, Sawston, UK. 5) Kuda T.(2017)Fermentation of fish-based products: A special focus on traditional Japanese products, p.355-369, Starter Culture in Food Production, Speranza et al. Ed., Wiley Blackwell, Chichester, UK. 6) 久田孝(2013)水産微生物,p.265-273,微生物の簡易迅速検査法,五十君ら監修,テクノシステム,東京. 7) 村尾澤夫(2001)発酵の歴史,「発酵ハンドブック」,p.438-440.栃倉ら監修、共立出版,東京 8) Ruas-Madiedo P, Rodríguez A.(2017)Non-starter bacteria ‘functional’ cultures, p.64-78, Starter Culture in Food Production, Speranza et al. Ed., Wiley Blackwell, Chichester, UK. 9) Olsson-Francis K, de la Torre R, Cockell CS.(2010)Isolation of novel extreme-tolerant Cyanobacteria from a rock-dwelling microbial community by using exposure to low earth orbital. Appl Environ Microbiol 76:2115-2121. 10) Cocktell C, et al.(2015). The 500-year microbiology experiment. Astronomy Geophysics 56:1.28-29. 11) 伊藤進(2012)バイオ洗剤とスクリーニング,生物工学 90:586-589. 12) Koschorreck M.(2008)Microbial sulphate reductionat a low pH, FEMS Microbiol Ecol 64:329-342. 13) Ishino S, Ishino Y.(2014)DNA polymerases as useful reagents for biotechnology – the history of developmental research in the field, Front Microbiol 5:465. 14) 石毛直道,ケネスラドル(1990)魚醤とナレズシの研究,岩波新書,東京. 15) 久田孝,矢野俊博(2010)魚介類の乳酸発酵食品 -能登のナレズシと加賀のカブラズシ-,日本食品微生物学会雑誌 27:185-195. 16) Kuda T, Tanibe R, Mori M, Take H, Michihata T, et al.(2009)Microbial and chemical properties of aji-no-susu, a traditional fermented fish with rice product in the Noto Peninsula, Japan, Fisheries Sci 75:1499-1506. 17) Kuda T, Yazaki T, Ono H, Takahashi H, Kimura B.(2013)In vitro cholesterol-lowering properties of Lactobacillus plantarum AN6 isolated from aji-narezushi. Lett Appl Microbiol 57:187-192. 18) Kanno T, Kuda T, An C, Takahashi H, Kimura B.(2012)Radical scavenging capacities of saba-narezushi, Japanese fermented chub mackerel, and its lactic acid bacteria. LWT-Food Sci Technol 47:25-30. 19) Nakamura S, Kuda T, An C, Kanno T, Takahashi H, et al.(2011)Inhibitory effects of Leuconostoc mesenteroides 1RM3 isolated from narezushi, a fermented fish with rice, on Listeria monocytogenes infection to Caco-2 cells and A/J mice. Anaerobe 18:19-24. 20) Kuda T, Kanno T, Kawahara M, Takahashi H, Kimura B.(2014)Inhibitory effects of Leuconostoc mesenteroides 1RM3 isolated from narezushi on lipopolysaccharide induced inflammation in RAW264.7 mouse macrophage cells and dextran sodium sulphate induced inflammatory bowel disease in mice. Journal Functional Foods 6:631-636. 21) 久田孝、庄田麻美、森村奈々、横山理雄(1998)金沢産かぶらずしおよびだいこんずしの微生物フローラ,日本水産学会誌 64:1053-1059. 22) Kuda T, Kaneko N, Yano T, Mori M.(2010)Induction of superoxide anion radical scavenging capacity in Japanese white radish juice and milk by Lactobacillus plantarum isolated from aji-narezushi and kaburazushi. Food Chem 120:517-522. 23) Kuda T, Noguchi Y, Ono M, Takahashi H, Kimura B, et al.(2014)In vitro evaluation of the fermentative, antioxidant, and anti-inflammation properties of Lactococcus lactis subsp. lactis BF3 and Leuconostoc mesenteroides subsp. mesenteroides BF7 isolated from Oncorhynchus keta intestines in Rausu, Japan. J Funct Foods 11:269-277. 24) Sorraza L, Padilla D, Acosta F, Roman L, Grasso J, et al.(2012). Characterization of the probiotic strain Vagococcus fluvialis in the protection of European sea bass (Dicentrarchus labrax) against vibriosis by Vibrio anguillarum, Vet Microbiol 155:369-373. 25) Kuda T, Kawahara M, Nemoto M, Takahashi H, Kimura B.(2014)In vitro antioxidant and anti-inflammation properties of lactic acid bacteria isolated fromfish intestines and fermented fish from the Sanriku Satoumi region in Japan. Food Res Int 64:248-255. 26) Nakata T, Hirano S, Yokota Y, Takahashi H, Kimura B, et al.(2016)Protective effects of heat-killed Lactococcus lactis subsp. lactis BF3, isolated from the intestine of chum salmon, in a murine model of DSS-induced inflammatory bowel disease, Biosci Microbiota Food Health 35:137-140. 27) Kuda T, Masuko Y, Kawahara M, Kondo S, Nemoto M, et al.(2016)Bile acid-lowering properties of Lactobacillus plantarum Sanriku–SU3 isolated from Japanese surfperch fish. Food Biosci 14:41-46. 28) Kowalczyk A, Eyice Ö, Schäfer H, Price OR, Finnegan CJ, et al.(2015)Characterization of para-nitrophenol-degrading bacterial communities in river water by using functional markers and stable isotope probing, Appl Environ Microbiol 81:6890-6900. 29) Hanne LF, Kirk LL, Appel SM, Narayan AD, Bains KK.(1993)Degradation and induction specificity in actinomycetes that degrade p-nitrophenol, Appl Environ Microbiol 59:3305-3508. 30) Kitagawa W, Kimura N, Kamagata Y.(2004)A novel p-nitrophenol degradation gene cluster from a Gram-positive bacterium, Rhodococcus opacus SAO101, J Bacteriol 186:4894-4902. 31) Kuda T, Kyoi D, Takahashi H, Obama K, Kimura B.(2011)Detection and isolation of p-nitrophenol-lowering bacteria from intestine of marine fishes caught in Japanese waters. Mar Poll Bull 62:1622-1627. 32) 大野正夫 編(2004)有用海藻誌,内田老鶴圃,東京. 33) Kuda T, Ikemori T.(2009)Minerals, polysaccharides and antioxidant properties of aqueous solutions obtained from macroalgal beach-casts in the Noto Peninsula, Ishikawa, Japan. Food Chem 112:575-581. 34) Kuda T, Nemoto M, Kawahara M, Oshio S, Takahashi H, et al.(2015)Induction of the superoxide anion radical scavenging capacity of dried ‘funori’ Gloiopeltis furcata by Lactobacillus plantarum S-SU1 fermentation. Food Funct 6:2535-2541. 35) Kuda T, Eda M, Kataoka M, Nemoto M, Kawahara M, et al.(2016)Anti-glycation properties of the aqueous extract solutions of dried algae products and effect of lactic acid fermentation on the properties. Food Chem 192:1109-1105. 36) Eda M, Kuda T, Kataoka M, Takahashi H, Kimura B.(2016)Anti-glycation properties of the aqueous extract solutions of dried algae products harvested and made in the Miura Peninsula, Japan, and effect of lactic acid fermentation on the properties. J Appl Phycol 28:3617-3624. 37) Nemoto M, Kuda T, Eda M, Yamkawa H, Takahashi H, et al.(2017)Protective effects of mekabu aqueous solution fermented by Lactobacillus plantarum Sanriku-SU7 on human enterocyte-like HT-29-luc cells and DSS induced murine IBD model. Probiotics Antimicro Prot 9:48-55. 38) Kuda T, Kunii T, Goto H, Suzuki T, Yano T.(2007)Varieties of antioxidant and antibacterial properties of Ecklonia stolonifera and Ecklonia kurome products harvested and processed in the Noto peninsula, Japan. Food Chem 103:900-905. 39) Kuda T, Matsuda A, Yasunaka H, Yano T.(2011)Characterization of Saccharomyces cerevisiae isolated from flower and algal beach casts in Ishikawa, Japan, using the one-step small moromi model, Jpn J Food Microbiol 28:114-122. 40) 久田孝、矢野俊博、松田章(2012)花および海岸漂着海藻より分離した酵母を用いた清酒小仕込試験,日本醸造協会誌107:205-209. 41) Kuda T, Kondo S, Usami Y, Ishizaki S, Takahashi H, et al.(2016)Reduction in the ammonia content of salmon shark meat by a fermented rice bran suspension with the Satoumi-sourced yeast Saccharomyces cerevisiae Misaki-1 and lactic acid bacteria Lactobacillus plantarum Sanriku-SU8. LWT-Food Sci Technol 68:244-250. 42) Kondo S, Kuda T, Nemoto M, Usami Y, Takahashi H, Kimura B.(2016)Protective effects of rice bran fermented by Saccharomyces cerevisiae Misaki-1 and Lactobacillus plantarum Sanriki-SU8 in dextran sodium sulphate-induced inflammatory bowel disease model mice. Food Biosci 16:44-49. 略歴久田 孝(くだ たかし) 賞罰平成10年度 日本水産学会奨励賞(水産化学分野) 研究分野食品微生物学、食品機能学 サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |

