|
インドネシア原産薬用植物を資源とするバイオプロスペクティング
岐阜大学 工学部 化学・生命工学科
教授 纐纈 守 はじめにインドネシアは、日本と比べ広大な面積の国土を有し、スマトラ島(47.4万km2)は島としての面積が世界第6位で日本の本州(22.8万km2)の2倍以上の大きさがあり、その中央部には広大な熱帯雨林を有している。特に植物(維管束植物)については、200 m2当たり218種と極めて多くの植物が確認され、薬用植物や食料などの豊富な生物資源の宝庫である(世界自然保護基金:WWF2001年調査)。しかし、その多くは未開拓で機能性を有した有効成分の研究がほとんどなされていない。インドネシアの豊富な薬用植物から化学成分を単離精製し、NMR(核磁気共鳴)を中心としそれらの単離した化学成分の構造解析を行う。さらにそれらの生理活性を網羅的に評価することによって新規医薬品シード物質の探索を行う。NMRは複雑な化合物の構造解析において非常に有力な手段である。 実験方法植物採集および抽出インドネシア スマトラ島から共同研究者によって植物が選定され、香椿(Toona sinensis)と樹蘭(Aglaia odorata)が採集された。それぞれの植物は日干し乾燥し、メタノールにて浸漬抽出後、n-ヘキサン、酢酸エチルを用いて液-液分配した。溶媒留去して各種有機溶媒層を得た。  機器分析1次元および2次元NMRはJEOL ECX 400 spectrometerを用い、TMSを内部標準物質とした。MSはJEOL JMS-700/GI spectrometerで測定した。LC-MS分析はAquity UPLC XevoQTofで行った。 生理活性評価細胞増殖抑制能の評価では、同仁社製CCK-8アッセイキットを用いた。2 × 104 cells/mLを96穴プレートに播種し、インキュベーター内(5% CO2, 37oC)で培養した。24時間後、DMSOに溶解した検体を添加し、さらに48時間培養した。CCK-8溶液を10 μL加え、2時間培養後、マイクロプレートリーダー(436 nm)で測定した。Hoechst 33342染色では、2 × 105 cells/mLを24穴プレートに播種し、同様の条件(検体濃度、時間および5% CO2, 37oC)で培養後、Hoechst 33342を5 μg/mLになるように加え、さらに30分間培養し蛍光条件下にて観察した。ギムザ染色では、同様に培養後、細胞を遠沈して回収後、PBSにて洗浄、プレパラートにメタノール固定しギムザ溶液で染色し観察した。 結果香椿(Toona sinensis)に関する研究香椿の葉(TSL)および幹部(TSW)の各種有機溶媒層を用いてヒト白血病HL-60細胞に対する増殖抑制能評価をCCK-8アッセイで行った。その結果、葉および幹部の酢酸エチル層が比較的強く増殖を抑制した。細胞生存率はそれぞれ12.0%および52.8%であった。Hoechst 33342染色を行い蛍光条件下にて観察したところ、核の断片化が確認された(Figure 1)。 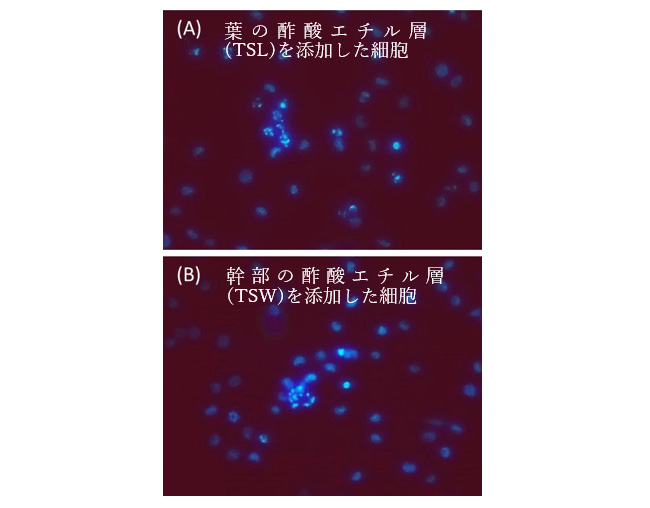 Figure 1. 香椿の葉の酢酸エチル層(TSL)および幹部の酢酸エチル層(TSW)(100 μg/mL)を 添加した細胞の形態(細胞はHoechst 33342で染色した) 香椿の葉(TSL)および幹部(TSW)の酢酸エチル層にヒト白血病HL-60細胞に対する細胞増殖抑制能が確認されたため、次にこれらに含有する活性化合物の単離・同定を行った。シリカゲル(SiO2)を用いたカラムクロマトグラフィー、オクタデシル基結合シリカゲル(ODS)カラムを用いたHPLC、分取用TLC(PTLC)などによる精製を行い、葉および幹部の酢酸エチル層からポリフェノール化合物を単離した。
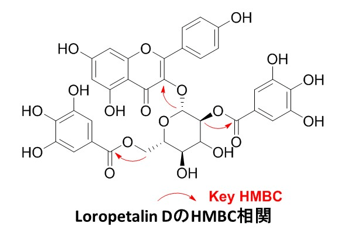
葉の酢酸エチル層から単離した化合物1の糖のアノメリックプロトン δH 5.68 (d)は、特徴的なフラボノール3位の炭素とHMBC相関が確認された。また、ddで2ヶ所に分かれて観測される糖6位およびCOSYで決定した2位のプロトンはエステルカルボニル炭素と相関が確認された。詳細なスペクトル解析の結果、化合物1はLoropetalin Dと決定した。この化合物はマンサク科常盤万作から単離例があるのみの非常に珍しい化合物であった。 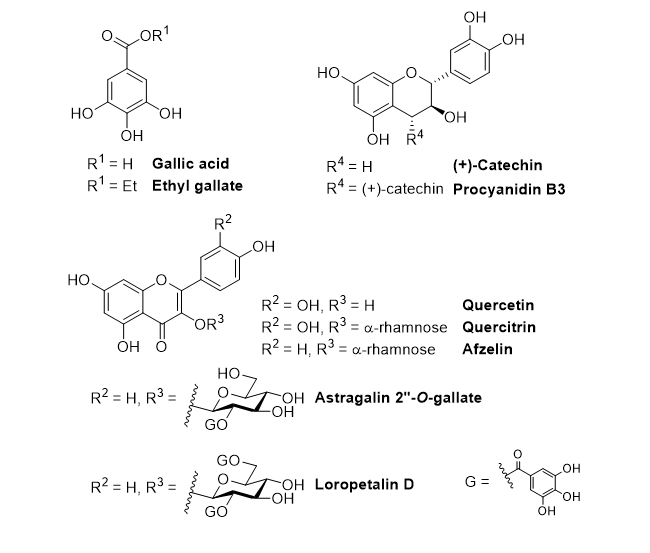 Figure 2. 香椿から単離した化合物の構造 そのほかにも葉の酢酸エチル層から6種(Gallic acid、Ethyl gallate、Quercetin、Quercitrin、Afzelin、Astragalin 2”-O-gallate)、幹部の酢酸エチル層から2種((+)-Catechin、Procyanidin B3)の化合物を同定した(Figure 2)。 Table 1. ヒト白血病細胞に対する単離化合物の細胞増殖抑制能(means ± SEMs, n = 6)  評価化合物7種の中ではGallic acid(細胞生存率4.3%)とLoropetalin D(細胞生存率24.6%)が強い阻害能を示した。また、Hoechst 33342およびギムザ染色を行い、顕微鏡で観察した結果、Gallic acidおよびLoropetalin Dを作用させた細胞では核の断片化が確認され、アポトーシスの誘導が推測された(Figure 3)。ギムザ染色した細胞では、Loropetalin Dを作用させた細胞の形状が崩れていることが確認された(Figure 4)。 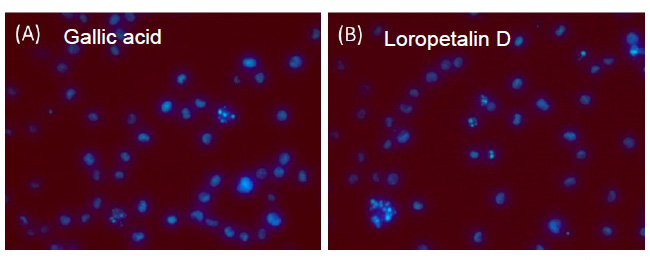 Figure 3. Gallic acid(A)およびLoropetalin D(B)(50 μM)を添加した細胞の形態 (細胞はHoechst 33342で染色した) 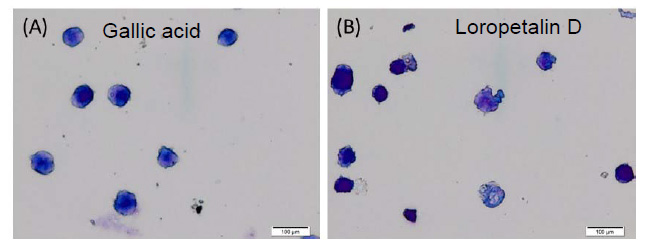 Figure 4. Gallic acid(A)およびLoropetalin D(B)(50 μM)を添加した細胞の形態 (細胞はギムザ染色した) Gallic acidとEthyl gallateを比較するとGallic acidの活性が強いことからカルボン酸へのエチル基の導入は活性を低下させることがわかる。また、Quercetin、Quercitrin、Afzelinにおいてもフラボノール3位水酸基へのラムノースの導入が活性を弱めた。Astragalin 2”-O-gallateとLoropetalin Dを比較するとLoropetalin Dの活性が強いことからケンフェロール配糖体のガロイル基の数が活性に影響を与えることが示唆された。これを検証するために他の植物から単離したKaempferolとKaempferol glucosideであるAstragalinを加えて比較検討を行った(Figure 5)。 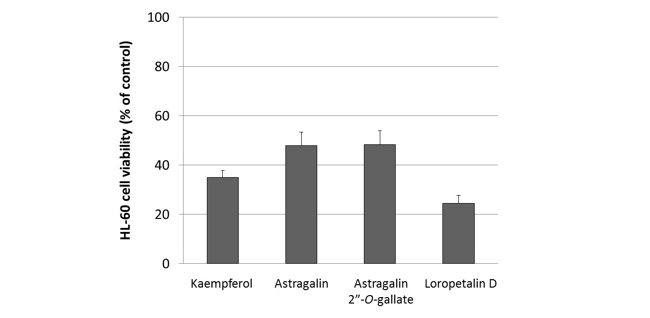 Figure 5. Kaempferol, Astragalin, Astragalin 2”-O-gallateおよびLoropetalin DのHL-60 細胞に対する細胞増殖抑制能の比較(means ± SEMs, n = 6) Quercetin、Quercitrin、Afzelinの場合と同様にKaempferolとAstragalinではKaempferolの活性が強いことからケンフェロール骨格へのグルコースの導入は活性を低下させることがわかる。AstragalinおよびAstragalin 2”-O-gallateではほぼ同程度の活性であることからガロイル基を1つ導入しても活性にはあまり影響を与えない結果となった。Loropetalin Dと比較すると活性が上昇していることからケンフェロール骨格への2つ以上のガロイル基導入は活性を強めることが証明された。 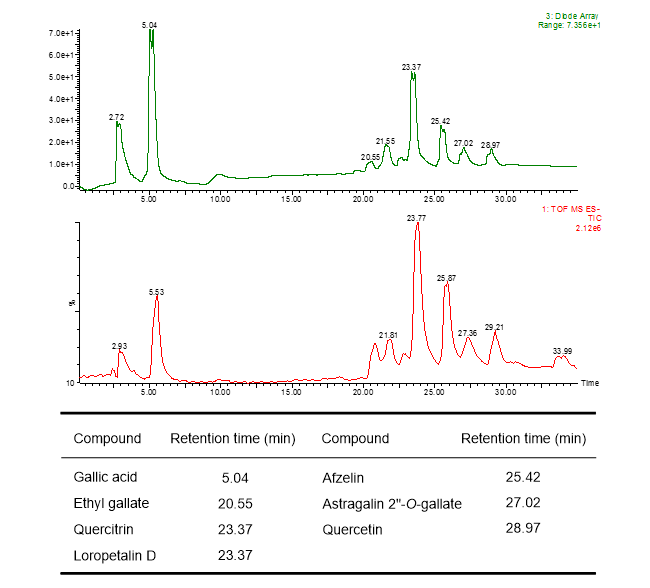 Figure 6. 香椿の葉の酢酸エチル層(TSL)のUPLC-MS分析 分析したクロマトグラムから単離した化合物が主成分であった。各成分の保持時間をFigure 6中の表にまとめた。特に活性が強かったGallic acidおよびLoropetalin Dの含有量が多いことからこの2化合物が葉の酢酸エチル層の活性の要因化合物であることが推測された。次に幹部の酢酸エチル層の分析を行った(Figure 7)。 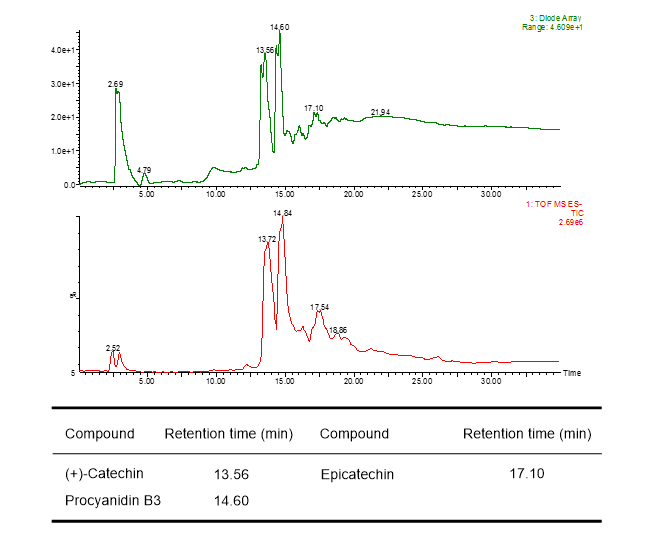 Figure 7. 香椿の幹部の酢酸エチル層(TSW)のUPLC-MS分析 単離した化合物((+)-Catechin、Procyanidin B3)以外にMS分析によりEpicatechinが同定された。これら3化合物が幹部の酢酸エチル層の主成分であり、活性の要因化合物であると考えられた。 樹蘭(Aglaia odorata)に関する研究まず成分同定のために樹蘭の葉の酢酸エチル層をシリカゲルカラムクロマトグラフィー、分取用TLC(PTLC)、再結晶などの精製からはじめ、4種の化合物を単離した。そのうちの2種はフラボノンである3’,7-Dimethoxyhesperetinおよびダマラン型トリテルペノイドであるDammar-20-ene-3β,24,25-triolであった(Figure 8)。 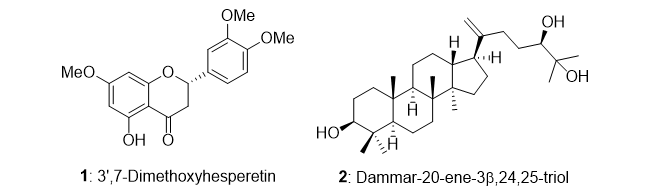 Figure 8. 樹蘭から単離した化合物1および2の構造 残り2種はドラゲンドルフ試薬によってアルカロイドであることが予測された。NMRを比較したところ、どちらの化合物も同様の基本骨格を有している可能性が示唆された。以下に1Hおよび13C NMRの特徴的な部分を示す(Figure 9)。 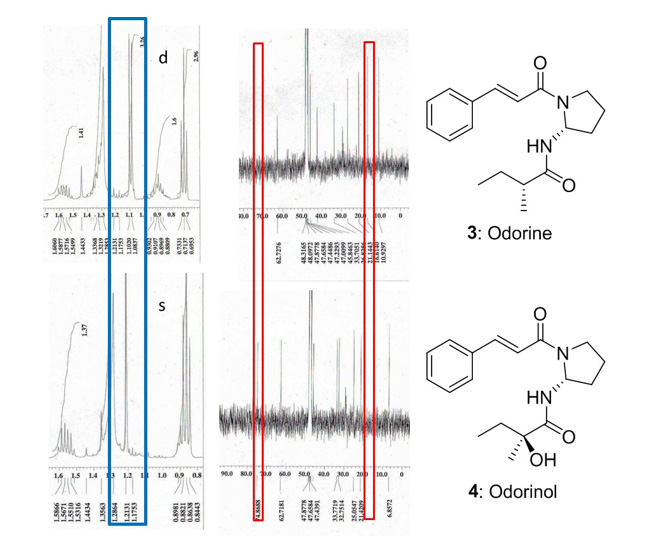 Figure 9. 化合物3および4のNMRの差異点 化合物3の青括弧で示した3Hプロトンはダブレットで割れていることから隣接する炭素が1つプロトンを持っていることがわかる。これに対して化合物4ではシングレットであることから隣接する炭素は四級である。また、これらのメチル炭素は化合物3に対して化合物4では低磁場シフトしていることより水酸基が存在していることがわかる。さらに詳細な2D NMRの解析により化合物3はOdorine、化合物4はOdorinolであると決定した。 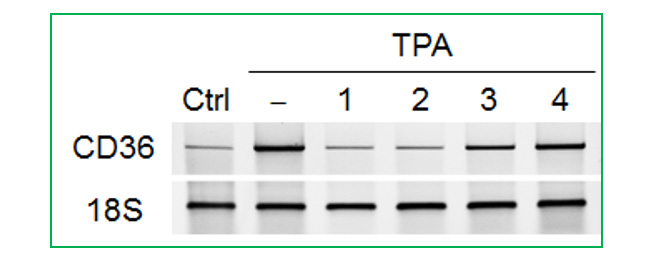 Figure 10. TPA誘導マクロファージ分化に対する単離した化合物の効果 参考論文1 Phytochemical analysis and antileukemic activity of polyphenolic constituents of Toona sinensis(A. Kakumu, M. Ninomiya, M. Efdi, M. Afda, M. Hayashi, K. Tanaka and M. Koketsu)Bioorganic & Medicinal Chemistry Letters, 24, 4286-4290(2014). 2 The isolation of secondary metabolites and in vitro potent anti-cancer activity of clerodermic acid from Enicosanthum membranifolium(M. Efdi, T. Itoh, Y. Akao, Y. Nozawa, M. Koketsu and H. Ishihara)Bioorganic & Medicinal Chemistry, 15, 3667-3671(2007). 3 N-trans-Feruloyltyramine as melanin biosynthesis inhibitor(M. Efdi, K. Ohguchi, Y. Akao, Y. Nozawa, M. Koketsu and H. Ishihara)Biological Pharmaceutical Bulletin, 30, 1972-1974(2007). 4 Chemical studies on Goniothalamus tapis Miq(M. Efdi, S. Fujita, T. Inuzuka and M. Koketsu)Natural Product Research, 24, 657-662(2010). 5 Chalcone glycosides from aerial parts of Brassica rapa L. ‘hidabeni’, turnip(M. Ninomiya, M. Efdi, T. Inuzuka and M. Koketsu)Phytochemistry Letters, 3, 96-99(2010). 6 Isolation of chemical constituents from Enicosanthum cupulare(King)Airy-Shaw(S. Fujita, M. Ninomiya, M. Efdi, K. Ohguchi, Y. Nozawa and M. Koketsu)Natural Product Research, 24, 1630-1636(2010). 7 Sentulic acid: a cytotoxic ring A-seco triterpenoid from Sandoricum koetjape Merr(M. Efdi, M. Ninomiya, E. Suryani, K. Tanaka, S. Ibrahim, K. Watanabe, and M. Koketsu)Bioorganic & Medicinal Chemistry Letters, 22, 4242-4245(2012). 8 Clerodane diterpenes isolated from Polyalthia longifolia induce apoptosis in human leukemia HL-60 Cells(D. P. Sari, M. Ninomiya, M. Efdi, A. Santoni, S. Ibrahim, K. Tanaka and M. Koketsu)Journal of Oleo Science, 62, 843-848(2013). 9 (R)-(-)-8-Hydroxy-3-methyl-3,4-dihydro-1H-2-benzopyran-1-one(M. Efdi, M. Koketsu, M. Ebihara and H. Ishihara)Acta Crystallographica Section. E, E62, o2135-o2137(2006). 10 2-(3-Hydroxy-4-methoxyphenyl)-N,N,N-trimethylethanaminium chloride(M. Efdi, M. Koketsu, M. Ebihara and H. Ishihara)Acta Crystallographica Section. E, E62, o2993-o2994(2006). 11 Antitermite activities of coumarin derivatives and scopoletin from Protium javanicum Burm. f.(M. Adfa, T. Yoshimura, K. Komura and M. Koketsu)Journal of Chemical Ecology, 36, 720-726(2010). 12 Antifeedant and termiticidal activities of 6-alkoxycoumarins and related analogs against Coptotermes formosanus Shiraki(M. Adfa, Y. Hattori, T. Yoshimura, K. Komura, and M. Koketsu)Journal of Chemical Ecology, 37, 598-606(2011). 13 Inhibitory effects of 6-alkoxycoumarin and 7-alkoxycoumarin derivatives on LPS/IFNγ-stimulated nitric oxide production in RAW264 cells(M. Adfa, T. Itoh, Y. Hattori, and M. Koketsu)Biological Pharmaceutical Bulletin, 35, 963-966(2012). 14 Antitermite activity of 7-alkoxycoumarins and related analogs against Coptotermes formosanus Shiraki(M. Adfa, Y. Hattori, T. Yoshimura, and M. Koketsu)International Biodeterioration and Biodegradation, 74, 129-135(2012). 15 Chemical constituents of Indonesian plant Protium javanicum Burm. f. and their antifeedant activities against Coptotermes formosanus Shiraki(M. Adfa, Y. Hattori, M. Ninomiya, Y. Funahashi, T. Yoshimura, and M. Koketsu)Natural Product Research, 27(3), 270-273(2013). 16 Effects of 2,2-dimethylchromenes against the feeding behavior of Coptotermes formosanus Shiraki(Y. Hiramatsu, M. Adfa, M. Ninomiya, T. Yoshimura and M. Koketsu)Journal of Pesticide Science, 38(4), 228-231(2013). 17 Comparison of antitermite properties of 2-thioxocoumarins against Coptotermes formosanus Shiraki(M. Ninomiya, T. Aoki, M. Adfa, T. Yoshimura, and M. Koketsu)Holzforschung, 68(3), 361-365(2014). 18 Termiticidal activity of Acorus calamus Linn. rhizomes and its main constituents against Coptotermes curvignathus Holmgren(A. Morina, L. Fio, Meita, N. Putri, M. Syalfinaf, M. Ninomiya, G. Irfan, P. A. M. Hadi, S. Rochmah and M. Koketsu)Journal of Asia-Pacific Entomology, 18, 47-50(2015). 19 Antileukemic activity of lignans and phenylpropanoids of Cinnamomum parthenoxylon(M. Adfa, R. Rahmad, M. Ninomiya, S. Yudha S., K. Tanaka, and M. Koketsu)Bioorganic & Medicinal Chemistry Letters, 26, 761-764(2016). 20 6-Benzyloxycoumarin(M. Adfa, M. Koketsu and M. Ebihara)Acta Crystallographica Section. E, E66, o2190(2010). (用語説明) 略歴纐纈 守(コウケツ マモル) 【略歴】 【加入学協会名】 平成16年9月~平成20年2月
有機合成化学協会東海支部常任幹事 【受賞歴】 サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |