|
メタノール酵母による異種タンパク質生産:高生産のための技術戦略
京都大学大学院 農学研究科 応用生命科学専攻
准教授 由里本 博也 1.はじめに食品産業に利用される酵素を含む産業用酵素、医療分野で利用される臨床診断用酵素や医薬品タンパク質など、様々なタンパク質が幅広い分野で利用されている。現在これらの有用タンパク質の多くが、遺伝子組換え技術を用いた異種タンパク質生産系によって生産されている。また実験室レベルでは、タンパク質の構造解析や機能未知タンパク質の機能解析のために、異種タンパク質生産系が利用されている。これまでに様々な異種タンパク質生産系が開発され、大腸菌などの原核微生物から、酵母やカビなどの真核微生物、昆虫細胞や動物細胞などの高等真核細胞まで、多様な宿主を利用することができる。どの宿主生物を用いるか、また各宿主生物においてどのような宿主細胞、発現ベクターを用いるかなど、目的とするタンパク質に応じて最適な系を選抜する必要があるが、一般に微生物を宿主とする異種タンパク質生産系は、宿主細胞の増殖量、目的タンパク質の生産量、培地や培養のコストの点で高等生物を宿主とするものに比べて優れている。一方、高等生物由来のタンパク質は、糖鎖付加などの翻訳後修飾がその機能発現に必須である場合があり、このようなタンパク質を生産する際には、翻訳後修飾が適切に起こる宿主を使用しなければならないが、酵母やカビなどの真核微生物は、実験操作や培養の簡便性に加えて、真核生物としての基本的な細胞構造と機能をもつことから、高等生物由来のタンパク質生産に有利である。 2.メタノール酵母の特徴と異種タンパク質生産メタノール酵母が世界で初めて報告されたのは1969年のことで、緒方らにより土壌から分離されたCandida boidinii(当時はKloeckera sp.)が最初の報告である1)。1970年代には、天然ガスから安価に製造できるメタノールを原料として飼料添加物としてのsingle cell protein(SCP)を生産する研究開発が行われ、メタノール酵母も主要な研究対象とされた。メタノールからのSCP生産は残念ながらオイルショックのために経済的に成り立たなくなったが、メタノール代謝経路の解明や乾燥菌体重量で100 g/L を超える高密度培養技術の開発など、その後のメタノール酵母の利用価値を高める基盤が築かれた。 3.異種タンパク質高生産のための技術戦略メタノール酵母の異種タンパク質生産系に限らず、目的タンパク質を活性型で高生産するためには、遺伝子の導入からタンパク質の取得に至るまでの様々なステップを最適化しなければならない。ここでは、メタノール酵母に特有の事情も踏まえながら、高生産のための技術戦略について、図1を基にして考えてみたい。 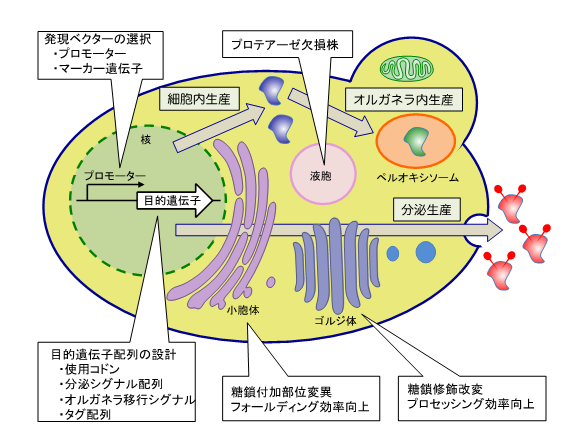 図1 メタノール酵母における異種タンパク質高生産のための技術戦略 最初に考慮すべきは、遺伝子発現用ベクターをどのように構築するか、すなわちプロモーターと形質転換マーカーの選択である。メタノール酵母の異種タンパク質生産に用いられるプロモーターには、大きく分けてメタノール誘導性プロモーターと構成的発現プロモーターの2種がある。メタノール誘導性プロモーターについては、P. pastorisではAOXをコードするAOX1プロモーターが一般的ではあるが、ホルムアルデヒド脱水素酵素(FLD)をコードするFLD1プロモーターなど他のメタノール誘導性プロモーターも利用できる。筆者らがC. boidiniiのメタノール誘導性プロモーターを比較したところ、DAS1が最も強力かつメタノール特異的に誘導されたことから、本プロモーターを異種遺伝子発現だけでなく、メタノールセンサー細胞の構築にも利用した10,11)。一方、構成的発現プロモーターには、解糖系のグリセルアルデヒド-3-リン酸デヒドロゲナーゼをコードするTDH3遺伝子プロモーター(GAPプロモーター)が用いられる。形質転換の際のマーカー遺伝子については、栄養要求性か薬剤耐性かのどちらかを用いる。メタノール酵母では、異種タンパク質生産のための形質転換はゲノム挿入型で行われるため、ほとんどの場合は遺伝子発現カセットがシングルコピー挿入される。高生産のためには当然マルチコピー挿入株が望ましいが、マーカー遺伝子に薬剤耐性遺伝子を用いると、培地に添加するゼオシンなどの抗生物質を高濃度にすることで、マルチコピー挿入株を得やすい。 4.おわりにメタノール酵母の異種タンパク質生産系では、これまでに多くの有用タンパク質が生産されてきた。その中には実用化されているものも多数あり、例えば植物油精製時の脱ガムに利用されるホスホリパーゼCなど、米国食品医薬品局(FDA)のGRAS(generally recognized as safe)物質として認証されているものもある19)。今後もこのようにメタノール酵母が生産する有用タンパク質の実用化例が増えていくものと期待される。メタノールを培養原料に用いることは、特に食品加工用酵素の生産時には消費者心理としてマイナスイメージとなることは否めないが、メタノールは天然ガスの主成分であるメタンや未利用バイオマスから合成可能な循環型炭素資源であるとともに、食糧と競合しない微生物培養原料であり、メタノールからの有用タンパク質生産は、微生物による循環型資源利用の観点からも重要である。 文献1 Ogata K, Nishikawa H, Osugi M. A yeast capable of utilizing methanol. Agric Biol Chem 33: 519-1520(1969) 2 Yurimoto H, Oku M, Sakai Y. Yeast methylotrophy: metabolism, gene regulation and peroxisome homeostasis. Int J Microbiol 2011: 101298(2011) 3 Cregg JM, Barringer KJ, Hessler AY, Madden KR. Pichia pastoris as a host system for transformations. Mol Cell Biol 5: 3376-3385(1985) 4 Gellissen G. Heterologous protein production in methylotrophic yeasts. Appl Microbiol Biotechnol 54: 741-750(2000) 5 Yurimoto H, Sakai Y. Methanol-inducible gene expression and heterologous protein production in the methylotrophic yeast Candida boidinii. Biotechnol Appl Biochem 53: 85-92(2009) 6 Raymond CK, Bukowski T, Holderman SD, Ching AFT, Vanaja E, Stamm MR. Development of the methylotrophic yeast Pichia methanolica for the expression of the 65 kilodalton isoform of human glutamate decarboxylase. Yeast 14: 11-23(1998) 7 Kuroda K, Kobayashi K, Tsumura H, Komeda T, Chiba Y, Jigami Y. Production of Man5GlcNAc2-type sugar chain by the methylotrophic yeast Ogataea minuta. FEMS Yeast Res 6: 1052-1062(2006) 8 Cregg JM (ed). Pichia protocols, second edition. Methods Mol Biol 389. Humana Press, Totowa, NJ(2007) 9 http://www.pichia.com 10 Yurimoto H, Komeda T. Lim CR, Nakagawa T, Kondo K, Kato N, Sakai Y. Regulation and evaluation of five methanol-inducible promoters in the methylotrophic yeast Candida boidinii. Biochim Biophys Acta 1493: 56-63(2000) 11 Kawaguchi K, Yurimoto H, Oku M, Sakai Y. Yeast methylotrophy and autophagy in a methanol-oscillating environment on growing Arabidopsis thaliana leaves. PLoS ONE 6: e25257(2011). 12 Damasceno LM, Anderson KA, Ritter G, Cregg JM, Old LJ, Batt CA. Cooverexpression of chaperones for enhanced secretion of a single-chain antibody fragment in Pichia pastoris. Appl Microbiol Biotechnol 74: 381-389(2007) 13 Gasser B, Sauer M, Maurer M, Stadlmayr G, Mattanovich D: Transcriptomics-based identification of novel factors enhancing heterologous protein secretion in yeasts. Appl Environ Microbiol 73: 6499-6507(2007) 14 Delic M, Rebnegger C, Wanka F, Puxbaum V, Haberhauer-Troyer C, Hann S, Köllensperger G, Mattanovich D, Gasser B. Oxidative protein folding and unfolded protein response elicit differing redox regulation in endoplasmic reticulum and cytosol of yeast. Free Radic Biol Med 52: 2000–2012(2012) 15 Jacobs PP, Geysens S, Vervecken W, Contreras R, Callewaert N. Engineering complex-type N-glycosylation in Pichia pastoris using GlycoSwitch technology. Nat Protoc 4: 58-70(2009) 16 Yurimoto H, Yamane M, Kikuchi Y, Matsui H, Kato N, Sakai Y. The pro-peptide of Streptomyces mobaraensis transglutaminase functions in cis and in trans to mediate efficient secretion of active enzyme from methylotrophic yeasts. Biosci Biotechnol Biochem 68: 2058-2069(2004) 17 Gleeson MA, White CE, Meininger DP, Komives EA. Generation of protease-deficient strains and their use in heterologous protein expression. Methods Mol Biol 103: 81-94(1998) 18 Sakai Y, Yoshida H, Yurimoto H, Yoshida N, Fukuya H, Takabe K, Kato N. Production of fungal fructosyl amino acid oxidase useful for diabetic diagnosis in the peroxisome of Candida boidinii. FEBS Lett 459: 233-237(1999) 19 Ciofalo V, Barton N, Kreps J, Coats I, Shanahan D. Safety evaluation of a lipase enzyme preparation, expressed in Pichia pastoris, intended for use in the degumming of edible vegetable oil. Regul Toxicol Pharmacol 45: 1-8(2006) 略歴由里本 博也(ユリモト ヒロヤ) 略歴:
1996年 京都大学大学院農学研究科修士課程修了
2001年 博士(農学) 2006年 京都大学大学院農学研究科助教授 2007年より現職 サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |

