|
酵母が醸すお酒の世界 -酵母のアルコール発酵と二日酔い対策-
岐阜大学 応用生物科学部
教授 中川 智行 1.はじめに人類は、太古の昔から酒を醸造し、嗜んできた。「神の恵み」と考えられていた酒は神聖なものとされ、神への捧げもの、さらには神と人々を結びつけるための重要なツールとして祭事や儀礼などで利用されてきた。また酒は「人間関係の潤滑油」でもあり、交渉事や冠婚葬祭、親睦の席でも飲用されるのみならず、報酬や贈り物、さらには税の対象としても利用するなど、人類は酒を巧妙に利用し、それぞれの生活・文化を築いてきた。 2.清酒酵母が醸す味と香り -清酒醸造における清酒酵母の機能と役割-私たちの先祖は微生物の存在を知る由もなく、神様のご機嫌を損なわないよう細心の注意を払いながら、アルコールを恵んでくれる最適な環境を見つけ出し、伝承してきた。しかし、アルコール発酵は神のなせる技ではなく、そこに住んでいる出芽酵母(蔵付酵母)がたまたま醪(もろみ)に入り込み、心地よくアルコール発酵を行ってくれる条件、つまり出芽酵母が優先的に生育できる条件を探ってきたのが現状である。 a.清酒酵母が持つ高い発酵力きょうかい酵母の最も優れている能力のひとつは、やはり「高い発酵力」にある。渡辺らは清酒酵母と実験室酵母の発酵力を、発酵条件を揃えて比較したところ、清酒酵母の方が発酵期間を通じて高い発酵速度を示し、最終的な醪中のアルコール度数は実験室酵母では10%台前半であるのに対し、清酒酵母では約18~20%にまで到達することを報告している10)。私たちの研究グループでも自然界から多数の出芽酵母Saccharomyces cerevisisaeを獲得してきたが9,11)、単離した野生酵母は遺伝的に清酒酵母と近縁であっても、きょうかい酵母に比べて発酵力が低い11)。では、清酒酵母が「高い発酵力」を持つ理由は何なのだろうか。 b.清酒酵母が醸す味と香り清酒を特徴づける重要な因子として「味」と「香り」があげられる。私たちは、食品を口に入れたときに感じる味覚や嗅覚などの総合的感覚から、その食品の「風味」を評価している。この「食品を口内に入れたとき感ずる香気」はフレーバーとも呼ばれ15)、複数の因子が複雑に影響し合うため、その表現や評価は難しい。近年、宇都宮らは、清酒中に確認することができる香味特性を表す用語を16のクラスに分類し、それらを車輪状に配列することで体系的にまとめた「清酒のフレーバーホイール」を提案した16)。このフレーバーホイールにあるように、清酒は果実様、花様、カラメル様、脂肪様、酸臭など、様々な香味特性から成り、それぞれの香りの絶妙なバランスのもと清酒の風味が成り立っている。特に吟醸酒の「フルーティーで華やかな香り」はフレーバーホイールのクラス1に分類されている「吟醸香」と呼ばれ、リンゴ様の香りのカプロン酸エチルとバナナ様の香りを持つ酢酸イソアミルがその代表格である(図1)。 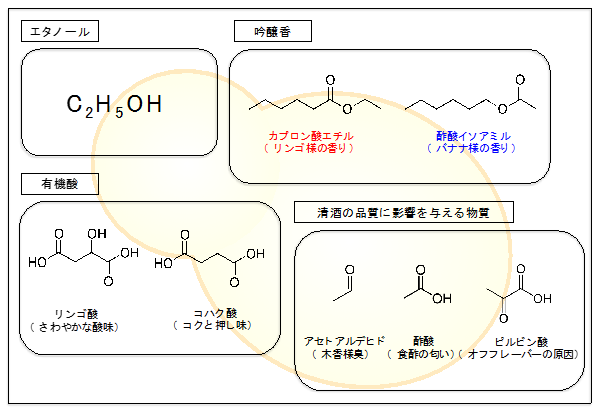 図1 清酒酵母が醸す清酒の品質に関与する化学物質 3.出芽酵母のアセトアルデヒド耐性機構と二日酔い対策美味しいお酒があり、仲間が集えばついついお酒がすすみ、飲み過ぎたあげく、次の日、二日酔いになる。その時は、もう同じ轍は踏むまいと心に誓うが、美味しいお酒があり、再び楽しい会が催されればまたお酒がすすむ…。人類はこれを何度繰り返してきたことだろうか。 a.出芽酵母のアセトアルデヒド耐性関連遺伝子群(AAT)の同定そのような背景のもと、私たちのグループでは出芽酵母の遺伝子破壊株コレクションを用いて、欠損することによりアセトアルデヒド感受性を示す50以上の遺伝子群を同定し、それらをアセトアルデヒド耐性関連遺伝子(AAT)と命名した25)。AATには様々な機能を持つ遺伝子群が含まれていることから、出芽酵母はあの手この手でアセトアルデヒド対策を行っていることが容易に想像できる。特に、ほとんど全てのペントースリン酸経路(PPP)の構成酵素をコードする遺伝子がAATに含まれており、PPPの遺伝子発現はアセトアルデヒドにより大きく上昇する25)。また、大部分の解糖系遺伝子の欠損株は逆にアセトアルデヒド耐性が上昇し、グルコースリン酸イソメラーゼ遺伝子PGI1の発現はアセトアルデヒドにより低レベルに抑制される26)。一方、転写制御因子であるStb5もまたAATの一員であり、欠損により強いアセトアルデヒド感受性を示す26)。そこでAAT の中でStb5によって発現が制御される遺伝子の同定を試みたところ、Stb5はアセトアルデヒド存在下ではPPP発現上昇とPGI1の発現抑制を同時に制御していた26)。このことは、出芽酵母はStb5を用いて一括的にグルコース代謝系を管理することで、アセトアルデヒド存在下ではPPPをより強力に活性化する方向に代謝を制御していることが伺える。実際、メタボローム解析を行ってみると、アセトアルデヒド存在下では細胞内においてPPPの代謝中間体の濃度が劇的に上昇する(未発表)。つまりPPPはアセトアルデヒド耐性機構において何らかの重要な役割を持つことが推察される。 b.アセトアルデヒド耐性機構におけるNADPHを要求する代謝系の機能と役割では、出芽酵母は何故、アセトアルデヒドストレス下でPPPを強化する必要があるのだろうか?PPPの生体内での主な役割は「NADPHの供給」と「五単糖の代謝」および「核酸合成へのリボースの供給」となっている。実際にメタボローム解析のデータを眺めてみると、アセトアルデヒドストレス下の出芽酵母は細胞内NADPH量を非ストレス条件下と比べて約3.3倍にまで増加させる(未発表)。さらにはNAD+キナーゼの欠損がアセトアルデヒド感受性を示すことからも(未発表)、アセトアルデヒドによるPPPの活性化は「NADPHの供給」が主要な役割であることが推測できる。一方、AATには3つのNADPH依存型酵素をコードする遺伝子OAR1、GLR1、HOM6が含まれていた25)。3つのNADPH依存型酵素のうちOAR1は、脂肪酸伸長反応系の3-オキソアシル[ACP]レダクターゼ(Oar1p)をコードしている25)。実際、出芽酵母はアセトアルデヒド存在下でStb5依存的にOAR1の発現を上昇させ、細胞内のオレイン酸(C18:1)量を増加させる25)。また、培養環境へのオレイン酸の添加は、PPP欠損のアセトアルデヒド感受性を一部解消する25)。つまり、出芽酵母のアセトアルデヒド耐性系に対するNADPH供給先のひとつはオレイン酸合成であることが示唆される。 このようにオレイン酸や還元型グルタチオンが出芽酵母の二日酔い対策の鍵因子であるといえる。これをヒトに置き換えてみると、日頃からオレイン酸が主成分のオリーブオイルやグルタチオンをたくさん含む肉料理をたくさん摂取しているイタリア人やスペイン人など地中海一帯の人々は酒に強いイメージがあるが、これが彼らの上戸の秘密ではないかと考えてしまう。 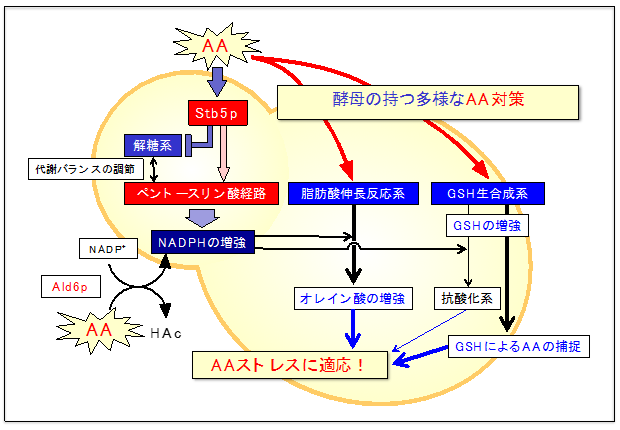 図2 これまで明らかとなってきた出芽酵母のアセトアルデヒド耐性機構 4.おわりに本稿では「酵母が醸すお酒の世界」と題して、(i)清酒醸造における出芽酵母の役割とその分子育種、さらには(ii)出芽酵母の持つアセトアルデヒドに対する細胞応答と毒性回避の分子機構を中心に解説してきた。出芽酵母は、アルコールを作り出す単なる道具ではなく、清酒の絶妙な風味を醸す職人である。特に、効率の良いアルコール発酵を遂行するために我が身を削り、また二日酔い状態に耐えながら、華やかで美味しいお酒を造り続けてくれている。さらには、私たちにアセトアルデヒドストレスに対する対処法のヒントを与えてくれる「二日酔い対策のプロ」でもある。つまり出芽酵母はお酒の醸造から飲み会のアフターケアまで、私たちを見守ってくれている心の師匠なのかもしれない。これからは出芽酵母に感謝しつつ、今日も美味しいお酒を楽しみたいものである。 参考文献1 Brooks PJ, Enoch MA, Goldman D, Li TK, Yokoyama A. PLoS Med. 6: e50(2009) 2 Eriksson CJP. Alcohol Clin Exp Res. 25: 15S-32S(2001) 3 Seitz HK, Stickel F. Nat Rev Cancer. 7: 599-612(2007) 4 Seitz HK, Stickel F. Genes Nutr. 5: 121-128(2010) 5 Seitz HK, Becker P. Alcohol Res Health. 30: 38-41, 44-47(2007) 6 瀧川智子. 日本職業・災害医学会会誌. 54: 193-199(2006) 7 吉田 清. 清酒酵母研究会. p100(1992) 8 赤尾 健. 化学と生物 52: 223-232(2014) 9 中川 智行, 鈴木 徹, 杉山 誠. 美味技術学会誌. 14: 2-6(2016) 10 渡辺 大輔. 50: 723-729(2012) 11 堀江 祐範, 中川 智行, 杉野 紗貴子, 吉村 明浩, 奈良 一寛, 梅野 彩, 吉田 康一, 岩橋 均, 田尾 博明. 美味技術学会誌. 15: 12-20(2016) 12 Watanabe D, Araki Y, Zhou Y, Maeya N, Akao T, Shimoi H. Appl Environ Microbiol. 78: 4008-4016(2012) 13 Watanabe D, Wu H, Noguchi C, Zhou Y, Akao T, Shimoi H. Appl Environ Microbiol. 77: 934-941(2011) 14 Noguchi C, Watanabe D, Zhou Y, Akao T, Shimoi H. Appl Environ Microbiol. 78: 385-392(2012) 15 大森 正司, 辻 美保子, 豊沢 功, 中川 昌平, 堀口 恵子, 宮川 金二郎. フードサイエンス―新しい食品学総論. 科学同人(1997) 16 宇都宮仁. 日本醸造協会誌 101, 730-739(2006) 17 堤浩子. 酒類の香気成分研究の新展開. 生物工学. 89:717-719(2011) 18 Ichikawa E, Hosokawa N, Hata Y, Abe Y, Suginami K, Imayasu S. Agric Biol Chem. 55: 2153-2154(1991) 19 大村智. ファルマシア. 13: 109-112(1977) 20 溝口(藤城)弘子,渡辺 睦,永井 英雄,西村 顕,近藤 恭一. 日本醸造協会誌. 93: 665-670(1998) 21 大場孝宏. 日本醸造協会誌. 103: 510-516(2008) 22 浅野忠男. 生物工学. 85: 63-68(2007) 23 Horie K, Oba T, Motomura S, Isogai A, Yoshimura T, Tsuge K, Koganemaru K, Kobayashi G, Kitagaki H. Biosci Biotechnol Biochem. 74: 843(2010) 24 吉田 清. 日本醸造協会誌. 101: 910-922(2006) 25 Matsufuji Y, Fujimura S, Ito T, Nishizawa M, Miyaji T, Nakagawa J, Ohyama T, Tomizuka N, Nakagawa, T. Yeast. 25: 825-833(2008) 26 Matsufuji Y, Nakagawa T, Fujimura S. Tani A, Nakagawa J. J Basic Microbiol. 50: 494-498(2010) 27 Matsufuji Y, Yamamoto K, Yamauchi K, Mitsunaga T, Hayakawa T, Nakagawa T. Appl Microbiol Biotechnol. 97: 297-303(2013) 28 Aranda A, del Olmo ML. Appl Environ Microbiol. 70: 1913-1922(2004) 29 Penninckx MJ. Enzyme Microb Technol. 26: 737-742(2000) 30 Penninckx MJ. FEMS Yeast Res. 2: 295-305(2002) 31 Kera Y, Kiriyama T, Komura S. Agents Actions. 17: 48-52(1985) 32 Anni H, Pristatsky P, Israel Y. Alcohol Clin Exp Res. 27: 1613-1621(2003) 33 Nagasawa HT, Elberling JA, Roberts J. J Med Chem. 30: 1373-1378(1987) 略歴中川 智行(ナカガワ トモユキ) サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |

