|
機能性表示食品、消費者はどう見るか?!
科学ジャーナリスト
一般社団法人 Food Communication Compass 代表 松永 和紀 機能性表示食品制度がはじまり約10カ月がたった。 とくに著しく弱いのが品質保証。安全性、機能性を実際の製品で担保するために重要なのは品質保証だが、根拠資料と同一、同等の成分が同量、製品に含まれているのか、製品はすべてのロットにおいて同じように安定生産されているのか、はっきりしない。また、機能性関与成分の定量法が多くの場合、公開されていない。つまり、適切に製造管理しているか、第三者は確認のしようがない。 制度の見直しが必要だろう。事業者自身による品質保証の改善、届出書類への詳細な記載、さらに業界としての品質保証ガイドライン策定なども求められる。同時に、情報を吟味して判断する「栄養情報リテラシー」を、消費者は身につけなければならない。機能性表示食品制度の概要と課題を整理する。 国の審査はなく、消費者が判断食品の機能性表示は、これまで栄養機能食品、特定保健用食品で限定的に認められていた。これに機能性表示食品が加わり、「保健機能食品」と位置づけられている(表1参照)。 サプリメント形状の加工食品(錠剤、カプセル剤、粉末剤、液剤等)、飲料などの一般加工食品に加え、生鮮食品も機能性を表示できる。ただし、効果をもたらす機能性関与成分は特定され定量可能でなければならず、青汁やローヤルゼリーなど「いわゆる健康食品」として売れ筋の商品の多くは、本制度の対象外となった。また、ビタミン、ミネラル類など食事摂取基準が定められている栄養素、アルコールを含有する飲料や脂質、ナトリウムなどの過剰摂取につながる食品も対象外とされた。 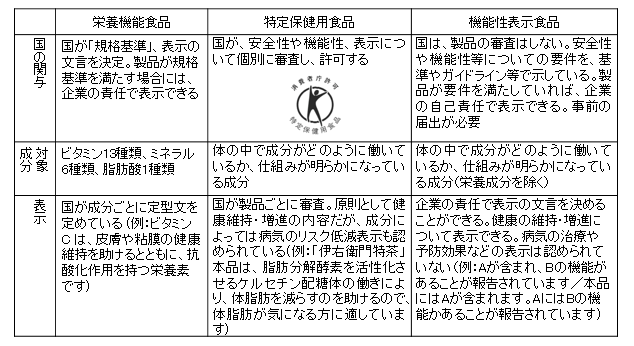 表1 3つの保健機能食品(栄養機能食品、特定保健用食品、機能性表示食品)の違い [安全性]−− 食経験が重んじられる①喫食実績による食経験の評価、②既存情報による食経験の評価、③既存情報による安全性試験結果の評価、④安全性試験の実施による安全性の評価・・・・・・の4つのステップで評価される。 [生産・製造及び品質管理]−− 健康被害の未然防止安全性の確保のために、生産・製造や品質管理のポイントについてもガイドラインで示されている。ただし、これらは要件ではなく、消費者の選択に資する情報として開示を要請されている。 [機能性]−− ヒトでの科学的根拠が求められる要求されるのは、①最終製品を用いた臨床試験、②最終製品または機能性関与成分に関する研究レビューのいずれかである。 ②の研究レビュー(システマティックレビュー)は、論文データベースを用い、リサーチクエスチョンを設定し関連する論文を選び出す。次いで、採択した論文を「totality of evidence」の観点から評価し、総合的に機能性について肯定的と判断できる成分・製品のみが、機能性を表示できるとされる。査読付き論文が1本もなかったり、肯定的な研究結果が複数あっても査読付き論文が支持しない場合は、表示できない。観察研究の場合、縦断研究(前向きコホート研究や症例対照研究等)は機能性表示の根拠となるが、横断研究は因果の逆転を生じやすいため、単独では根拠となり得ず、介入試験等との組み合わせにより機能性を実証することとなる。 「長官審査はなし」表示も必要これらの内容を書類に記載し消費者庁に届け出る。容器包装には、表2の項目を表示することが義務づけられた。「本品は、事業者の責任において特定の保健の目的が期待できる旨を表示するものとして、消費者庁長官に届出されたものです。ただし、特定保健用食品とは異なり、消費者庁長官による個別審査を受けたものではありません。」というdisclaimer(打ち消し表示)も必要だ。 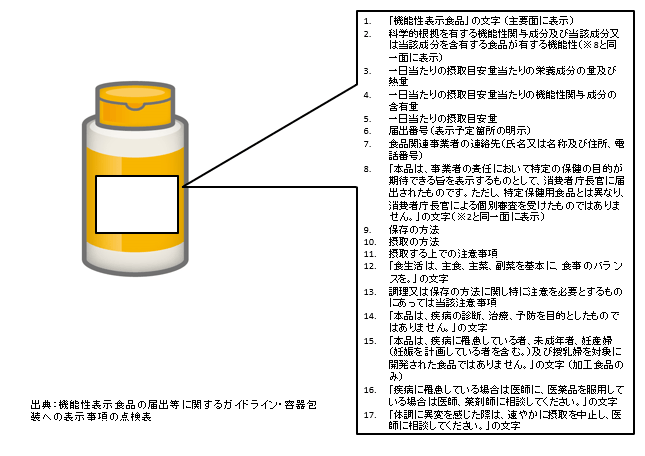 表2 機能性表示食品の容器包装に表示が義務づけられている項目 製品が上市され、課題がぞくぞく2016年1月10日現在、178製品が届出を受理されている(うち2製品は事業者が取り下げ、1製品は別製品として出し直された)(2)。内訳は生鮮食品2品(みかん、大豆もやし)、一般加工食品80品(飲料、食用油など)、サプリメント形状の加工食品96品である。機能性の内容は、体脂肪や内臓脂肪の低下、血中の中性脂肪低減、目の健康維持、肌の潤い維持など多岐にわたる。トクホにおいて認可された成分と機能性を活かし、表示する製品も多い。 (1)安全性における「食経験」の判断に混乱いわゆる健康食品としての販売歴を「食経験」とし、それ以上の安全性評価を行っていない製品が目立つ。サプリメントとしての販売歴がわずか1年半しかないものも「食経験あり」ですまされている。 (2)安全性におけるトクホとの整合性が不明トクホ審査で「安全性が確認できない」として不許可答申となった成分を機能性関与成分とする製品が、機能性表示食品として受理された。 専門家集団である食品安全委員会が安全性に懸念を持ち、事実上却下した成分が、機能性を表示して売られるという異例の事態である。全国消費者団体連絡会等の消費者団体は、「公的組織が問題ありと判断した製品や機能性関与成分は、機能性表示食品として受理すべきでない」と消費者庁に求めているが、回答はない(6)。 (3)機能性の科学的根拠(エビデンス)が弱く、効果も小さな製品が目立つフードファディズム研究で有名な高橋久仁子・群馬大学名誉教授は、全国消費者団体連絡会主催のメディア懇談会で5月、「制度の問題が多々ある。機能性表示食品は、企業責任で表示する制度だが、科学的根拠があると言える訳がないでしょう、というものが受理されている。言った者勝ちになり、これからますますひどいものになるのではないか」と発言した。 ところが、機能性関与成分の表示の根拠として示された論文の多くは、ごく小規模な二重盲検無作為割付試験がほとんど。しかも1報か多くても数報であり、作用機序の解明が行われておらず推測にとどまる製品も多い。しかも、効果はおおむね、わずかである。 (4)品質保証が適正に行われているか、外部評価ができない安全性や機能性の担保は、製品の品質保証が適正に行われているのが大前提だ。前述のとおり、健康被害がこれまで出ていないと主張されても、販売してきた製品と、これから販売される機能性表示食品が同等であることが示されなければ、安全の根拠とはならない。機能性においても、論文で扱われた試験試料における機能性関与成分と同等の量が機能性表示食品に含まれ、同等の活性を持つことが求められる。 さらに、機能性表示食品として、常に同じものを製造し続け提供できるのか、というのも大きなポイントだ。製造ロットごとに違いがあってはならないのだ。通常の食品は、農水畜産物が天候や生育条件等による大きなばらつきを避けられないため、加工食品においても多少のばらつきが生じるし、消費者も許容する。しかし、機能性表示食品は特定の機能性関与成分により健康への効果をわざわざ表示する以上、効果を担保する高度な品質保証が不可欠だ。 ところが、機能性関与成分の分析法すら公開されていない。栄養機能食品で効果を表示できる栄養成分は、公定法があり、第三者が含有量を調べ表示が正しいかどうかチェックできる。だが、機能性表示食品の機能性関与成分は事業者独自の成分であることが多く、分析法は一般に確立されていない。含有量すら測定できないのでは、検証は不可能で、品質保証を第三者が評価する術がない。 第三者の分析によるチェックを重視する理由は、「いわゆる健康食品」でこれまで、数々の品質不正が明らかになっているためだ。 合田部長らは、最近もブラックコホシュという「女性の更年期障害を改善したり骨粗鬆症を予防する」と伝えられるハーブの遺伝子分析や化学分析の結果を、論文で発表している。日本で、ブラックコホシュとして売られる製品を調べたところ、Cimicifuga racemosaという種であるべきなのに、Cimicifuga dahuricaやCimicifuga foetidaが間違って基原として使われたものが高い割合であった(9)(10)。 合田部長らは、ブラックコホシュについては、判別する分析法をまず作り、それから製品の検証を行った。本来企業が責任を持って間違いない基原を用いるべきなのだが、それを第三者が検証するには、膨大な時間と費用、人的資源を割かなければならない。 (5)消費者への説明、情報開示が不十分本制度は、米国のダイエタリーサプリメント制度が販売後届出制を採用し問題が相次いでいることから、販売前届出制を導入した。消費者庁がその書類を開示し、販売前から国民が自由にアクセスできるようにすることが検討会報告書では求められ、同庁は販売の60日前までの届出をガイドラインで規定した。ところが、消費者庁の書類手続きが滞り、届出書類の公開から販売開始まで1週間を切る製品まで出た。これでは、消費者の販売前の検証は難しい。また、企業の届出情報をそのまま開示し消費者が判断する制度としながら、消費者への説明が著しく不足している。消費者庁は、事業者向けに内容を明らかにする説明会を全国各地で開いているのに、消費者に安全性や有効性等の考え方等の基本からわかりやすく解説し「消費者教育」へとつなげるような姿勢は、見られないのだ。 食品の機能性への懐疑以上、とくに重要と思われる課題を述べた。実のところ、食品の機能性については、懐疑的な見方が強まっているのが世界的な潮流だ。一般市民が抱く「自然、天然だから安全」というイメージが間違っているのは、言うまでもない。さまざまな自然毒研究が、人工、自然にかかわらずリスク評価が必要であることを示している(11)。 さらに、機能性のエース格とみられていた抗酸化物質も見直しが進む。細胞を用いた試験や動物試験等で、生活習慣病や発がんなどのリスク低減が認められ、ヒトでも積極的な摂取が勧められるようになった。しかし、大規模な疫学試験でむしろリスクが上昇する場合があることが確認されている(12)。動物試験でも、がん細胞の転移や侵襲を増強するとの結果が出てきた(13)。体に悪く抗酸化物質で消去すべきとされていた活性酸素が、生体防御に一定の役割を果たしており、一概に消去すべきとは言えないことが徐々にわかってきている。 食品安全委員会も2015年12月、「健康食品」に関する報告書とメッセージをまとめ、「食品」であっても安全とは限らない/多量に摂ると健康を害するリスクが高まる/ビタミン・ミネラルをサプリメントで摂ると過剰摂取のリスクがある/「健康食品」は医薬品ではなく、品質の管理は製造者任せ/誰かにとって良い「健康食品」があなたにとっても良いとは限らない・・・・・・などの注意喚起を国民に対して行っている(14)。 食品安全委員会はこの報告書で、いわゆる健康食品だけでなく、特定保健用食品、栄養機能食品、機能性表示食品も含めて「健康食品」として定義している。これほど厳しいメッセージを、機能性表示食品も含めた「健康食品」に対して、専門家である食品安全委員会が突きつけたことは、非常に重要な意味を持つ。 終わりに食品には、一次機能(栄養)、二次機能(感覚・嗜好)に加え、三次機能(健康の維持や向上に関与する生体調節機能)があるとされる。三次機能への期待は今後も続き、研究も行われるだろう。 新制度によって、根拠となった論文などの情報がある程度は公開されるようになったのは、消費者のリテラシーを高めるうえで大きな進展だ。だが、品質保証などの情報開示は不十分なまま。それに、制度を作った国、そして消費者庁による、消費者への基礎的な栄養教育は不足している。 引用文献
略歴松永和紀 サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |

