|
植物色素アントシアニンのサイエンス-化学、機能と活用-
中部大学応用生物学部
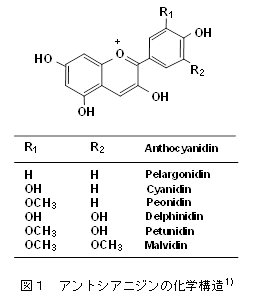
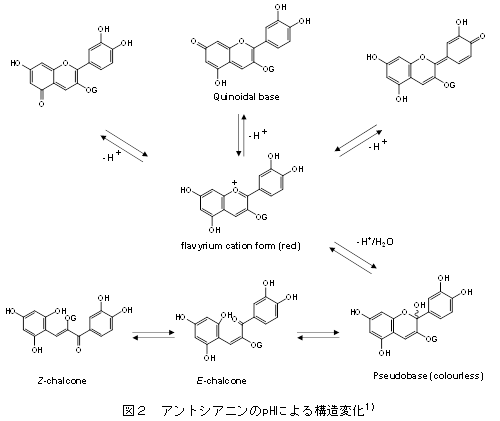
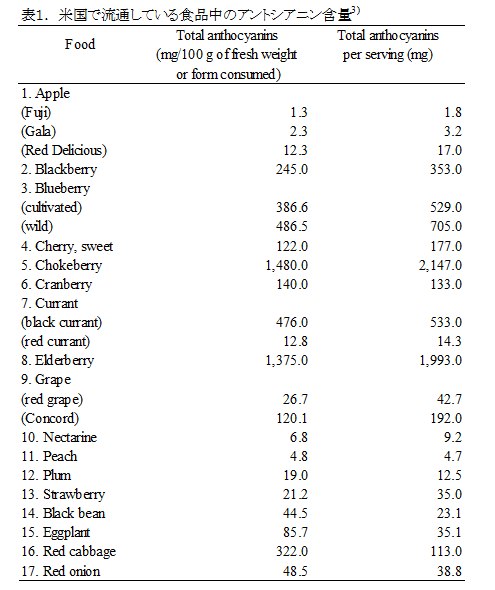
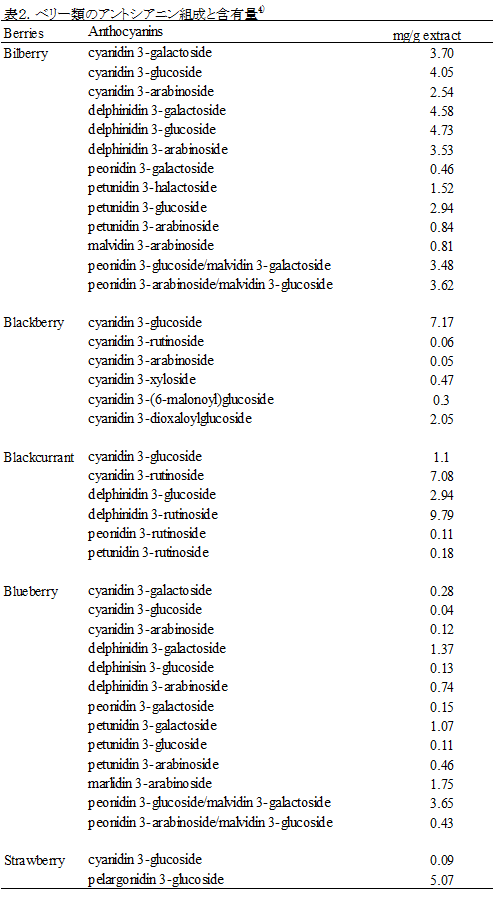
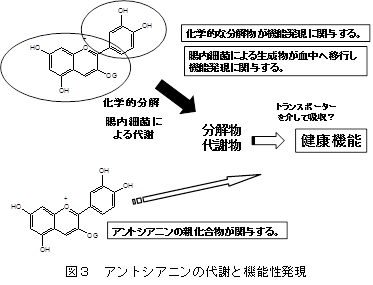
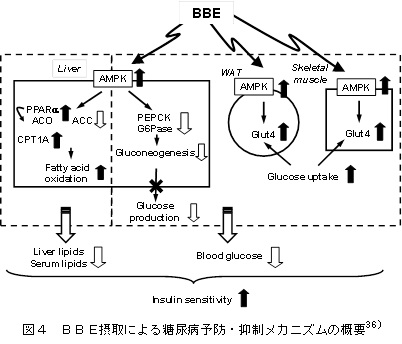
教授 津田 孝範 1.はじめに「アントシアニン」はフラボノイド系の植物色素で、ブドウやリンゴ、イチゴ、ブルーベリー等の果実、ナス、シソ、マメ種子の美しい赤色や紫色の色素成分の多くはアントシアニンで構成されている。また花の色も、その多くはアントシアニンによる色である。これまでに食品化学分野では、果実類などの加工保存中における色調の変化と安定性や天然着色料としての応用についての研究が行われてきた。アントシアニンは食用色素としてもすでに多くの種類が開発され、実際に食品の着色に用いられている。園芸面からは、花の色の変換が実現している。特に遺伝子改変による青色のバラの作出は特筆すべき成果であり、これまでになかった色を持つ花を飾ることで、私たちの生活に潤いを与えてくれる。これはアントシアニンの生合成に関わる遺伝子とその発現機構が解明され、遺伝子工学的手法を用いた花の色の変換が可能になったからである。アントシアニンに関する研究は、化学的な研究あるいは植物での生合成に関する研究が主体であったが、この20年ほどの間に、食品に含まれる生理機能成分として注目すべき研究対象となり、その生理機能研究に加えて、代謝やバイオアベイラビリティに関しても研究が進展している。 2.化学、給源と摂取量、代謝・吸収1) 化学アントシアニンは、一般には植物中では糖と結合した形(配糖体)として存在する。色素本体である糖以外の部分(アグリコン)は、アントシアニジンと呼ばれる。アントシアニンは、B環の置換基、結合糖の種類と数、アシル基の有無により多くの種類がある。主に存在するアントシアニジンは、ぺラルゴニジン、シアニジン(Cy)、デルフィニジン(Del)、ぺオニジン、ぺチュニジン、マルビジンの6種である(図1)1)。アントシアニンの色調は、B環の置換基により異なり、水酸基の数が増加するに従い、深色化し、メトキシル基の存在は浅色化をもたらす。図2に水溶液中でのアントシアニンの構造変化を示す1)。アントシアニンは、強酸性では、フラビリウム型といわれる構造をとり、赤色を呈し、比較的安定であるが、弱酸性、中性領域では、水分子と反応して無色のプソイド塩基に変換し、不安定である2)。 2) 給源と摂取量アントシアニンの含量は、植物や品種により大いに異なり、収穫時期によっても異なる。アントシアニンは、穀類、いも類、野菜類、豆類、果実類等、我々が常食している多くの植物に存在しているが、B環に水酸基を2個持つCy系の分布が最も広く、Del系がこれについでいる。日本国内の食品中のアントシアニン量に関するデータはないが、米国で流通している食品中に含まれる平均的なアントシアニン量の比較を表1に示す3) 。主にベリー類の果実に多く含まれ、米国人は1日に12.5 mgを食事から摂取していると報告されている。1日あたりの総アントシアニン摂取量は、個人差が大きいと考えられるが、日本人はおそらく米国人より摂取量は少ないかもしれない。なお、主なベリー類に含まれるアントシアニンの組成と含有量についても報告されている (表2)1),4)。 数年前にEuropean Prospective Investigation into Cancer and Nutrition studyとしてヨーロッパ10カ国の36,037人(年齢35歳~74歳)のアントシアニジン摂取量に関する詳細な研究成果が発表されている5) 。この報告によると、アントシアニジンの平均摂取量は、男性の場合、19.8 mg /日から64.9 mg /日、女性の場合は18.7 mg/日から44.1 mg/日であった。その摂取量には明確な傾向があり、ヨーロッパ北部から南部に向うに従い、その平均摂取量が高くなった。アントシアニジン摂取量は、非肥満の高齢女性、非喫煙者で高く、その摂取量は教育レベルと身体活動とともに増加した。主要な給源は、果物、ワイン、ノンアルコール飲料や野菜だった。日本人にとっては、アントシアニンの給源を考えた場合、ベリー類などの果実はアントシアニンを多く含むが、毎日毎食の摂取を実現しようとする場合、野菜の方が摂取容易かもしれない。野菜類のアントシアニン含量は比較的低いため、アントシアニンを豊富に含む野菜の作出が安定的なアントシアニンの摂取に貢献するかもしれない。さらに農産物についても機能性表示が可能になったことから、アントシアニンの高含有野菜あるいは果実は今後重要な対象となるであろう。さらにこれらの素材を用いたアントシアニンを豊富に含む飲料も同様にアントシアニンの摂取に貢献する可能性がある。 3) 代謝・吸収と機能発現アントシアニンの代謝・吸収については、著者らの報告をはじめ、その多くは配糖体のままで直接生体内へ吸収されると報告されている6) 。著者らはアントシアニンの代謝物として、シアニジン 3-グルコシド(C3G)のB環に由来するprotocatechuic acidが検出されることを報告していた6) 。最近では、アントシアニンの腸内細菌による分解と生成されたフェノール酸の関与が重要視されている。アントシアニンの代謝物として、その化学構造に由来するprotocatechuic acid 、syringic acid、vanillic acid、phloroglucinol aldehyde、phloroglucinol acid、gallic acidなどのフェノール酸が検出されるとする報告が相次いでいる7-14) 。アントシアニンが腸内細菌による代謝を受けること、あるいは化学変化によりこれらのフェノール酸が生成すると考えられ、ヒトにおいてもその存在が認められている15) 。アントシアニンの健康機能への関与として、これらの代謝物の作用を考慮する必要がある(図3)。 これまでアントシアニンのバイオアベイラビリティはかなり低い(0.1 %程度)と考えられてきたが、Kayらの研究グループは、13CでラベルしたC3Gを用いたヒトでの代謝・吸収に関する研究成果を発表している16)。この研究では8名の成人男性ボランティアに500 mgの13Cラベル化C3Gを摂取してもらい、48時間にわたり血液、尿、糞、呼気への排出を調べた。これによると、13Cは24-48時間後でも排泄され、検出された抱合体や代謝物は多様であり、バイオアベイラビリティは12.38 ± 1.38 %以上と算出された。さらにこの研究グループはC3Gに由来する分解物、代謝物についても検討しており、C3Gやそのアグリコン(シアニジン)の抱合体以外に、分解物としてprotocatechuic acidとそのグルクロン酸抱合体や硫酸抱合体、vanillic acidとその関連化合物とその抱合体、phenylacetic acids(3,4-dihydroxyphenylacetic acid、4-hydroxyphenylacetic acid)、phenylpropenoic acids(caffeic acid、ferulic acid)、hippuric acidが検出された。C3Gは化学的な分解、さらに腸内細菌等でかなり複雑な代謝を受け、これらが再吸収されていると考えられる。他の研究グループもブルーベリードリンクを摂取すると、血漿に多様なフェノール酸が認められることを報告している17)。これらの化合物は、摂取後すでに1時間で血中に検出され、最大ピークを示す化合物と、数時間後になって検出される化合物があり、アントシアニン等の分解物あるいは代謝物と考えられる。Kaltらの研究グループは、ヒトにおいて250 mLのブルーベリージュースの摂取後にアントシアニンの代謝物がアントシアニンを含まない食事を摂取していても5日間にわたり尿中に排泄されることを報告している18)。この現象はアントシアニンの代謝物が腸肝循環し、長く留まっていることを示唆すると考えられる。これらの報告からフェノール酸関連化合物等の代謝物や分解物のみでアントシアニンの健康機能が説明できるかについては、まだエビデンスが不足しているものの、健康機能との関連付けは興味あるところである。なお最近Kayらの研究グループは、C3Gの多様な代謝物を調製し、この代謝物が生理的な濃度でもヒト血管内皮細胞での炎症を抑制することを報告しており19,20)、今後の研究の進展が期待されている。 3.アントシアニンの肥満・糖尿病予防・抑制作用アントシアニンの健康機能に関わる研究は、抗酸化作用から始まっているが、これまでに種々の健康機能が報告されている。特にこの10年ほどの間でアントシアニンの健康機能とその分子レベルでの作用メカニズムの解明に関わる研究は大きく進展している。この項では、アントシアニンの肥満・糖尿病に対する予防・抑制作用に関する最近の研究を示す。 1) 肥満アントシアニンの体脂肪蓄積抑制に関する最初の報告は2003年に著者らにより報告された21) 。C3G(2 g/kg)を含む食餌(C3G食)は、C57BL/6Jマウスにおいて、高脂肪食(エネルギー源の60 %が脂肪由来)により誘導される体脂肪蓄積を有意に抑制し、このメカニズムは肝臓、白色脂肪組織の脂肪合成の低下によるものであるとしている21,22)。このとき、高脂肪食により誘導される血清グルコース濃度もC3G食の摂取により有意に低下した。Priorらの研究グループは、ブルーベリーから抽出したアントシアニンを高脂肪食(エネルギー源の45 %が脂肪由来)へ添加した食餌をC57BL/6マウスへ摂取させたとき、このアントシアニン抽出物の摂取は、体重増加と体脂肪蓄積を抑制するが、ブルーベリー果実の凍結乾燥により得たブルーベリーパウダー(WBP)の摂取はむしろ脂肪蓄積を促すと報告している23) 。同グループは別の研究において、高脂肪食(45 %エネルギー)を摂取させたマウスのブルーベリージュース摂取は体重と体重に占める白色脂肪組織(精巣上体脂肪、後腹膜脂肪)の重量%に有意な低下をもたらさなかったことを報告している24)。同様にDeFuriaらは、C57BL/6マウスにおいて、WBPの摂取は高脂肪食(60 %エネルギー)による体重増加を有意に抑制しないことを報告している25) 。ところが、大変興味深いことに、最近Seymourらは、2 %のWBPを添加した高脂肪食(45 %エネルギー)がZucker Fatty ratsにおいて腹腔内脂肪量の低下をもたらし、脂肪組織と骨格筋のperoxisome proliferator-activated receptor(PPAR)活性を上昇させることを報告している26) 。しかし同研究グループは、Zucker Lean ratsにおけるWBP摂取は、むしろ体重増加を誘導することも報告している26) 。 2) 糖尿病アントシアニンの摂取は2型糖尿病モデルにおいて血糖値の上昇抑制、インスリン感受性の改善をもたらす。このことは著者らにより高純度のアントシアニン(C3G)の摂取22,35)、多様な種類のアントシアニンを含むビルベリーアントシアニン(BBE)の摂取36)、黒大豆成分(C3G、プロシアニジン)のいずれにおいても報告している37)。著者らは、単離C3Gの摂取は2型糖尿病モデルマウス(KK-Ay)において血糖値の上昇を抑制し、インスリン感受性を改善するが、この作用メカニズムとしてレチノール結合タンパク質4(RBP4)の発現低下が関係していることを明らかにしている35)。Yang、GrahamらはRBP4が新たなアディポサイトカインとして2型糖尿病の発症にリンクしており、インスリン抵抗性の原因分子であると報告している38)。ヒトにおける生理的意義については、完全に結論が出ていないが、マウスモデルでのC3Gの糖尿病抑制効果は、この理論によりメカニズムを説明することが可能である。すなわち、C3Gの摂取はGlucose transporter4(Glut4)の発現上昇をもたらし、このことがRBP4の発現を低下させることにより末梢組織でのインスリン感受性を改善し、糖新生の亢進によるグルコースの流出を抑制すると考えられる35) 。なお、最近の報告では、マウス3T3-L1脂肪細胞、ヒト脂肪細胞においてC3Gとその代謝物であるprotocatechuic acidはPPARγの活性化をもたらすと同時にGlut4とアディポネクチンの発現上昇を誘導することが報告されている39)。しかし著者らの研究では、C3GはPPARγのリガンドとして作用せず、in vivoでのアディポネクチン発現上昇をもたらさない33,35) 。従ってC3Gの糖尿病抑制効果は、PPARγリガンド作用やアディポネクチンの発現上昇によるものと結論できない。 3) ヒト介入試験アントシアニンのメタボリックシンドローム関連ヒト介入試験についても最近多くの報告がある。そのいくつかをアントシアニンを豊富に含むベリー類を中心とした事例で紹介する。 4.課題と今後の展望アントシアニンの健康機能について、代謝・吸収に加えて肥満・糖尿病予防・抑制作用に関する研究動向を概説した。最後にまとめとしてアントシアニンの健康機能研究に関する課題を提示する。 文献1) T. Tsuda. (2012) Dietary anthocyanin-rich plants: biochemical basis and recent progress in health benefits studies Mol. Nutr. Food Res. 56, 159-170. 2) R. Brouillard. (1988) Flavonoids and flower color. In: Harborne, J.B., (Ed.), The flavonoids. London: Chapman and Hall; 525-538. 3) X. Wu et al., (2006) Concentration of Anthocyanins in Common Food in the United States and Estimation of Normal Consumption. J. Agric. Food. Chem., 54, 4069-4075. 4) K. Ogawa et al., (2008) Anthocyanin composition and antioxidant activity of the Crowberry (Empetrum nigrum) and other berries. J. Agrc. Food Chem. 56, 4457-4462. 5) R. Zamora-Ros et al., (2011) Estimation of the intake of anthocyanidins and their food sources in the European Prospective Investigation into Cancer and Nutrition (EPIC) study. Br. J. Nutr. 106, 1090–1099. 6) T. Tsuda et al., (1999) Absorption and metabolism of cyanidin 3-O-β-D-glucoside in rats. FEBS Lett. 449, 179-182. 7) K. Keppler et al., (2005) Metabolism of anthocyanis and their phenolic degradation products by the intestinal microflora. Bioorg. Med. Chem. 13, 5195–5205. 8) A. M. Aura et al., (2005) In vitro metabolism of anthocyanins by human gut microflora. Eur. J. Nutr. 44, 133–142. 9) J. He et al., (2005) Analysis of anthocyanins in rat intestinal contents – impact of anthocyanin chemical structure on fecal excretion. J. Agric. Food Chem. 53, 2859–2866. 10) S. C. Forester et al., (2008) Identification of Cabernet Sauvignon anthocyanin gut microflora metabolites. J. Agric. Food Chem. 56, 9299–9304. 11) S.C. Forester et al., (2010) Gut metabolites of anthocyanins, gallic acid, 3-O-methylgallic acid, and 2,4,6-trihydroxybenzaldehyde, inhibit cell proliferation of Caco-2 cells. J. Agric. Food Chem. 58, 5320-5327. 12) M. Avila et al., (2009) Bioconversion of anthocyanin glycosides by Bifidobacteria and Lactobacillus. Food Res. Int. 42, 1453–1461. 13) M. P. Gonthier et al., (2003) Microbial aromatic acid metabolites formed in the gut account for a major fraction of the polyphenols excreted in urine of rats fed red wine polyphenols. J. Nutr. 133, 461–467. 14) G. Borges et al., (2007) The bioavailability of raspberry anthocyanins and ellagitannins in rats. Mol. Nutr. Food Res. 51, 714–725. 15) P. Vitaglione et al., (2007) Protocatechuic acid is the major human metabolite of cyanidin-glucosides. J. Nutr. 137, 2043–2048. 16) C. Czank et al., (2013) Human metabolism and elimination of the anthocyanin, cyanidin-3-glucoside: a 13C-tracer study. Am. J. Clin. Nutr. 97, 995-1003. 17) A. Rodriguez-Mateos et al., (2013) Intake and time dependence of blueberry flavonoid–induced improvements in vascular function: a randomized, controlled, double-blind, crossover intervention study with mechanistic insights into biological activity. Am. J. Clin. Nutr. 98, 1179-1191. 18) W. kalt et al., (2014) Anthocyanin metabolites are abundant and persistent in human urine. J. Agric. Food Chem. 55, 2489-2496. 19) H.P. Amin, et al., (2015) Anthocyanins and their physiologically relevant metabolites alter the expression of IL-6 and VCAM-1 in CD40L and oxidized LDL challenged vascular endothelial cells. Mol. Nutr. Food Res. 59, 1095-1106. 20) M. Edwards et al., (2015) Phenolic metabolites of anthocyanins modulate mechanisms of endothelial function. J. Agric. Food Chem., 63, 2423-2431. 21) T. Tsuda et al., (2003) Dietary cyanidin 3-O-β-D-glucoside-rich purple corn color prevents obesity and ameliorates hyperglycemia in mice. J. Nutr. 133, 2125-2130. 22) T. Tsuda et al., (2008) Regulation of adipocyte function by anthocyanins; possibility of preventing the metabolic syndrome. J. Agric. Food Chem. 56, 642-646. 23) R. L. Prior et al., (2008) Whole berries versus berry anthocyanins: interactions with dietary fat levels in the C57BL/6J mouse model of obesity. J. Agric. Food Chem. 56, 647-653. 24) R. L. Prior et al., (2010) Purified blueberry anthocyanins and blueberry juice alter development of obesity in mice fed an obesogenic high-fat diet. J. Agric. Food Chem. 58, 3970–3976. 25) J. DeFuria et al., (2009) Dietary blueberry attenuates whole-body insulin resistance in high fat-fed mice by reducing adipocyte death and its inflammatory sequelae. J. Nutr. 139, 1510-1516. 26) E. M. Seymour et al., (2011) Blueberry intake alters skeletal muscle and adipose tissue peroxisome proliferator-activated receptor activity and reduces insulin resistance in obese rats. J Med Food. 14, 1511–1518. 27) R. L. Prior et al., (2009) Purified berry anthocyanins but not whole berries normalize lipid parameters in mice fed an obesogenic high fat diet. Mol. Nutr. Food Res. 53, 1406-1418. 28) R. L. Prior et al., (2010) Dietary black raspberry anthocyanins do not alter development of obesity in mice fed an obesogenic high-fat diet. J. Agric. Food Chem. 58, 3970-3976. 29) L. Kaume et al., (2012) The Blackberry Fruit: A Review on Its Composition and Chemistry, Metabolism and Bioavailability, and Health Benefits. J Agric Food Chem. 60, 5716–5727. 30) C. H. Peng et al., (2011) Mulberry water extracts possess an anti-obesity effect and ability to inhibit hepatic lipogenesis and promote lipolysis. J. Agric. Food Chem. 59, 2663–2671. 31) E. M. Seymour et al., (2009) Regular tart cherry intake alters abdominal adiposity, adipose gene transcription, and inflammation in obesity-prone rats fed a high fat diet. J. Med. Food. 12, 935-942. 32) B. Qin et al., (2011) An extract of chokeberry attenuates weight gain and modulates insulin, adipogenic and inflammatory signalling pathways in epididymal adipose tissue of rats fed a fructose-rich diet. Br J Nutr. 108, 581-587. 33) T. Tsuda et al., (2004) Anthocyanin enhances adipocytokine secretion and adipocyte-specific gene expression in isolated rat adipocytes. Biochem. Biophys. Res. Commun. 316, 149 –157. 34) T. Tsuda et al., (2006) Microarray profiling of gene expression in human adipocytes in response to anthocyanins. Biochem. Pharmacol. 71, 1184-1197. 35) R. Sasaki et al., (2007) Cyanidin 3-glucoside ameliorates hyperglycemia and insulin sensitivity due to downregulation of retinol binding protein 4 expression in diabetic mice. Biochem. Pharmacol. 74, 1619-1627. 36) M. Takikawa et al., (2010) Dietary anthocyanin-rich bilberry extract ameliorates hyperglycemia and insulin sensitivity via activation of AMP-activated protein kinase in diabetic mice. J. Nutr. 140, 527-533. 37) Y. Kurimoto et al., (2013) Black soybean seed coat extract ameliorates hyperglycemia and insulin sensitivity via the activation of AMP-activated protein kinase in diabetic mice. J. Agric. Food Chem. 61, 5558−5564. 38) Q. Yang et al., (2005) Serum retinol binding protein 4 contributes to insulin resistance in obesity and type 2 diabetes. Nature 436, 356-362. 39) B. Scazzocchio et al., (2011) Cyanidin-3-O-β-glucoside and protocatechuic acid exert insulin-like effects by upregulating PPARγ activity in human omental adipocytes. Diabetes. 60, 2234–2244. 40) A. Basu et al., (2010) Blueberries decrease cardiovascular risk factors in obese men and women with metabolic syndrome. J. Nutr. 140, 1582-1587. 41) A.J. Stull et al., (2010) Bioactives in blueberries improve insulin sensitivity in obese, insulin-resistant men and women. J. Nutr. 140, 1764-1768. 42) A. Jennings et al., (2014) Intakes of anthocyanins and flavones are associated with biomarkers of insulin resistance and inflammation in women. J. Nutr. 144, 202-208. 43) P.J. Curtis et al., (2009) Cardiovascular disease risk biomarkers and liver and kidney function are not altered in postmenopausal women after ingesting an elderberry extract rich in anthocyanins for 12 weeks. J. Nutr. 139, 2266-2271. 44) O.R. Wright et al., (2013) A randomized, double-blind, placebo-controlled trial of the effect of dried purple carrot on body mass, lipids, blood pressure, body composition, and inflammatory markers in overweight and obese adults: the QUENCH trial. Can. J. Physiol. Pharmacol. 91, 480-488. 略歴津田孝範(ツダ タカノリ) サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |