| ◆ HOME >栄養成分分析の実際 その2 〜栄養表示(ビタミン)〜 |
 |

栄養成分分析の実際 その2 〜栄養表示(ビタミン)〜
 はじめに
前回に引き続き、『栄養表示基準における栄養成分等の分析方法』について解説をします。今回はビタミン分析関連になります。
食品中のビタミン分析は栄養表示基準ができる前から行われており、数々の改良が加えられ今日に至っています。特に微生物定量法以外の分析方法は高速液体クロマトグラフが導入されたことで大きく変わっています。しかしながら、栄養表示基準の方法には、測定方法が高速液体クロマトグラフになっただけで、精製方法に手が加えられていないものや、現在では使われていない分析方法が載せてあったりします。それに加えビタミン分析関連では注意書きが多く、分析上重要なことが載せてあったりしますので注意が必要です。今回はそのような点も踏まえて解説します。
1.ビタミンA(レチノール、カロテン)
栄養表示基準では、ビタミンAはレチノールとカロテンから計算されます。収載されている分析方法は『高速液体クロマトグラフ法:レチノール(ビタミンAアルコール)』『吸光光度法:総カロテン』『高速液体クロマトグラフ法:α-カロテン、β-カロテン』の3種類です。基本的には、レチノールとカロテンを別々に測定し、係数を掛けて足し合わせレチノール当量を算出します。レチノール1μgは、α-カロテン24μg、β-カロテン12μgに相当します。
(1)高速液体クロマトグラフ法:レチノール(ビタミンAアルコール)
検査フロー
| 試料採取 |
|
| | |
|
| 加熱けん化 |
水酸化カリウム |
| | |
|
| 溶媒抽出 |
ヘキサン-酢酸エチル混液 |
| | |
|
| 精 製 |
アルミナカラムクロマトグラフィー |
| | |
|
| 測 定 |
高速液体クロマトグラフィー |
試料をピロガロール-エタノール中で水酸化カリウムにより加熱けん化を行い、次いで、不けん化物をヘキサン-酢酸エチル混液で抽出することにより、不純物の除去とレチノールを遊離(アルコール体)の状態にして回収します。
以前は、ジエチルエーテルで抽出をしていたため溶媒中に混入するアルカリ成分を水洗によって除去しなければなりませんでしたが、ヘキサン-酢酸エチル混液では溶媒中にアルカリ成分が混入しないため水洗が不要になっています。
アルミナカラムクロマトグラフィーは以前にレチノールとカロテンを同時に抽出し、光度計で測定していた時の名残で、高速液体クロマトグラフでカラム分離を行い測定している現在では、必ずしも必要な操作ではないため、注意書きでは省略してよいことになっています。
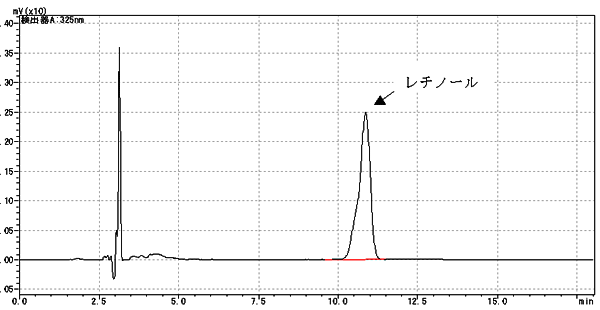
以前に行っていた三塩化アンチモン蛍光光度法ではレチノールのトランス体とシス体の分離ができなかったため、総レチノール(総レチノールの定義はありませんが、あえて総レチノールと表現させてもらいました)としていた関係上、高速液体クロマトグラフ法でもトランス体とシス体を分離させずに測定します。注意書きでもトランス体にシス体を含めるように書かれています。また、栄養表示基準の方法に載っている高速液体クロマトグラフ条件はトランス体とシス体が重なる条件ですが、分離のよいカラムですと肩ができたりします、その場合は含めるようなピーク処理をすることが必要です。
(レチノールクロマトグラム例)
(2)吸光光度法:総カロテン
現在ではあまり使われていない方法です。レチノール抽出でのアルミナカラムクロマトグラフィー部分でカロテン画分を分取し、ヘキサンで定容したものを453nmの吸光度を測定します。カロテンの吸光係数E(1%,1cm)=2592を用いて試料中のカロテン含量を求めます。
この方法ではα‐カロテンとβ‐カロテンの分離は出来ないため総カロテンになります。
また、キサントフィル類であるクリプトキサンチンはカロテン画分に入ってきません。
レチノール当量への換算は、以前のままの1/6総カロテン(μg)となっており、現在使われているα‐カロテンとβ‐カロテンの係数と相違していますので注意が必要です。
(3)高速液体クロマトグラフ法:α-カロテン、β-カロテン
検査フロー
| 試料採取 |
|
| | |
|
| 加熱けん化 |
水酸化カリウム |
| | |
|
| 溶媒抽出 |
ヘキサン-酢酸エチル混液 |
| | |
|
| 測 定 |
高速液体クロマトグラフィー |
基本的にはレチノールと同様の操作を行います。ジュース類は、加熱けん化前にエタノールと無水硫酸ナトリウムを用いてエタノール抽出を行い、その一部を加熱けん化します。野菜類なども、この操作を加えることにより抽出効率が改善されることがあります。
本文中にはカロテン含量が多く測定上の妨害となる成分が少ないニンジンジュースなどはエタノール抽出液を直接、高速液体クロマトグラフに導入できるとされています。
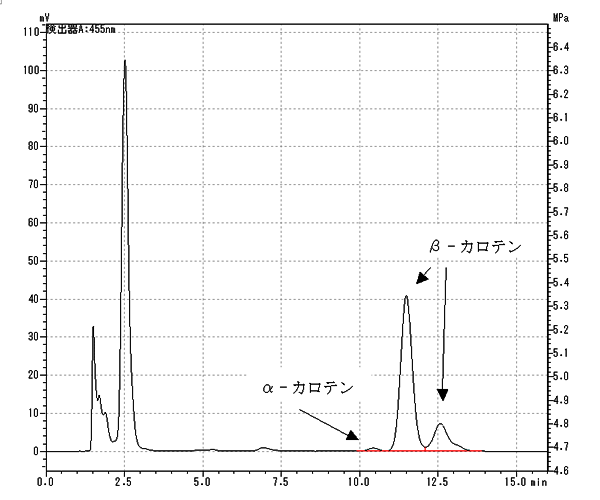
収載されている高速液体クロマトグラフ条件はβ‐カロテンのシス体も分離されてしまいますが、トランス体の面積値にシス体を含めて計算することが注意書きに載っています。
カロテンクロマトグラム例
2.ビタミンB1
ビタミンB1で収載されている方法は、『高速液体クロマトグラフ法』と『チオクローム法』になります。どちらの方法も結合型のチアミンを遊離型にして測定します。ビタミンB1の測定値はチアミン塩酸塩としての数値になります。生体内でチアミンの一形態で存在するヒドロキシエチルチアミンもチアミンとされていますのでビタミンB1に含めます。
食品添加物として許可されているチアミン類で、栄養表示基準の方法では測定できないものが注意書きに載っているので確認が必要です。
(1)高速液体クロマトグラフ法
検査フロー
| 試料採取 |
|
| | |
|
| 酸抽出 |
塩酸 |
| | |
|
| 酵素分解 |
タカジアスターゼ |
| | |
|
| 精 製 |
パームチットカラムクロマトグラフィー |
| | |
|
| 測 定 |
高速液体クロマトグラフィー |
試料を塩酸で加熱分解後、タカジアスターゼでリン酸を切断し、次いでイオン交換樹脂のパームチットカラムで脱着することで精製します。精製された検液を高速液体クロマトグラフで測定をしますが、カラム分離後、フェリシアン化カリウム‐水酸化ナトリウム溶液でチオクロームを生成させ、蛍光検出器で測定します。
精製に使用されるパームチットカラムでのチアミンの脱着は、25%塩化カリウム‐0.1mol/L塩酸溶液を使用しますが、塩の析出が激しくカラムが詰まってしまうため、溶液を沸騰状態にして脱着操作を行います。この操作は迅速に行わなければならない上に、やけどなどの危険が伴います。この操作は次に説明します以前に主流であったチオクローム法の名残で、現在では高速液体クロマトグラフィーでカラム分離されるため省略されることが多いです。
酵素分解に使用されているビタミンB1定量用タカジアスターゼは、すでに終売になっていますので、今後の動向に注意する必要があります。
(2)チオクローム法
原理は高速液体クロマトグラフ法と同じですが、測定に蛍光光度計を使用します。3本の試験管を同時に振って反応させたり、ベンゼンを使用したりと検査に対して障害が多いため、現在ではほとんど行われていません。
3.ビタミンB2
ビタミンB2で収載されている方法は、『高速液体クロマトグラフ法』と『ルミフラビン法』になります。高速液体クロマトグラフ法は酸分解で遊離状態にしたリボフラビンを測定するのに対し、ルミフラビン法はリボフラビンを変化させたルミフラビンを測定します。
(1)高速液体クロマトグラフ法
検査フロー
| 試料採取 |
|
| | |
|
| 酸抽出 |
塩酸 |
| | |
|
| 酵素分解 |
タカジアスターゼ |
| | |
|
| 測 定 |
高速液体クロマトグラフィー |
試料を塩酸で加熱分解後、タカジアスターゼでリン酸を切断し高速液体クロマトグラフで測定をします。精製に使用するタカジアスターゼにはビタミンB2が少量含まれているためロット毎に補正する必要があります。
食品添加物に用いられるビタミンB2酪酸エステルは、酸分解を行うことで総ビタミンB2として求めることができると注意書きに載っていますが、酵素分解後に酸分解を行った方が上手く遊離体に出来る場合があります。
(2)ルミフラビン法
試料を高速液体クロマトグラフ法と同様に処理し、遊離体にしたリボフラビンをアルカリ状態下で光照射を行うことでルミフラビンに変化させ、その蛍光強度を測定します。この方法は光の当たり方や夾雑物等の影響で再現性が非常に悪いのに加え、操作が煩雑であることから現在は行われておりません。
4.ビタミンC
栄養表示基準の方法には、『2,4-ジニトロフェニルヒドラジン法』『インドフェノール・キシレン法』『高速液体クロマトグラフ法』『酸化還元滴定法』『逆相高速液体クロマトグラフ法』の5種類の方法が収載されていますが、『高速液体クロマトグラフ法』が一般的です。
s
測定原理として主に2種類の方法に分けられます。直接、還元型のビタミンCを測定する『インドフェノール・キシレン法』『酸化還元滴定法』と還元型のビタミンCを酸化型ビタミンCに変化させ、すべての酸化型のビタミンCを誘導体化して測定する『2,4-ジニトロフェニルヒドラジン法』『高速液体クロマトグラフ法』になります。
(1)2,4-ジニトロフェニルヒドラジン法
インドフェノールにより還元型ビタミンCを酸化型に変えた後、チオ尿素で過剰に進む酸化反応停止させます。次いで、2,4-ジニトロフェニルヒドラジンで誘導体化し85%硫酸に溶解させ540nmの吸光度を測定します。測定以外の原理は『高速液体クロマトグラフ法』と同じですが、硫酸での吸光度測定などの煩雑さで現在はほとんど行われていません。
(2)インドフェノール・キシレン法
インドフェノール・キシレン法は還元型のビタミンCを測定するインドフェノール滴定法を改良した方法です。インドフェノール滴定法はビタミンCの還元力をインドフェノールの着色で滴定します。一方、インドフェノール・キシレン法は還元型ビタミンCと反応しない残存インドフェノールをキシレンに転溶させ、その吸光度を測定します。色素成分等の着色でインドフェノール滴定法が適用できない試料が対象になります。ビタミンC以外の還元物質が存在すると誤差になるので注意が必要です。また、酸化型のビタミンCは測定されません。
簡易的にビタミンCを測定する方法としては、インドフェノール滴定法の方が簡便です。
(3)高速液体クロマトグラフ法
検査フロー
| 試料採取 |
|
| | |
|
| 磨砕抽出 |
メタリン酸溶液 |
| | |
|
| 酸 化 |
インドフェノール |
| | |
|
| 酸化停止 |
チオ尿素 |
| | |
|
| オサゾンの生成 |
2,4-ジニトロフェニルヒドラジン |
| | |
|
| 転 溶 |
酢酸エチル |
| | |
|
| 測 定 |
高速液体クロマトグラフィー |
2,4-ジニトロフェニルヒドラジン法と同様にインドフェノールによりビタミンCを酸化型ビタミンCに変えた後、チオ尿素で過剰に進む酸化反応停止させます。次いで、2,4-ジニトロフェニルヒドラジンで誘導体化し、生成したオサゾンを酢酸エチルに転溶させ、順相の高速液体クロマトグラフで測定します。
インドフェノールを滴下したときに赤紫色に着色しますが、直ぐに着色が消えるようですと還元物質の量が多く酸化が完全に進んでいないのでインドフェノールの滴下量を増やすか還元型ビタミンC量が多いので希釈を行わないといけません。
酸化停止のチオ尿素は、過剰の酸化防止するためインドフェノール滴下して混合後、速やかに投入します。
栄養表示基準の方法に示されている2,4-ジニトロフェニルヒドラジンでのオサゾン生成条件は、完全に反応が終了する条件ではないので、標準溶液と試験溶液を同時に反応させる必要があります。
 |
 |
図1 インドフェノールを滴下した状態
右端はインドフェノール溶液 |
図2 インドフェノール滴下後混合した状態
右端は還元物質の過多により色が消失 |
 |
 |
図3 ヒドラジンの反応後の状態
オレンジ色の浮遊物がオサゾン |
図4 酢酸エチルに転溶した状態
オレンジ色の部分が酢酸エチル層 |
(4)酸化還元滴定法
酸化還元滴定法はヨウ素を還元するビタミンCを滴定する方法です。ビタミンC以外の還元物質が含まれると正確な値となりません。インドフェノールでの滴定法が簡便であるため、現在ではほとんど使われない方法です。
(5)逆相高速液体クロマトグラフ法
逆相高速液体クロマトグラフ法はアスコルビン酸2-グルコシドを直接逆相高速液体クロマトグラフで測定する方法です。精製操作が入らないのでクロマト上で妨害が出やすい方法です。アスコルビン酸2-グルコシドはジニトロヒドラジン法、イインドフェノール・キシレン法、高速液体クロマトグラフ法、酸化還元滴定法では測定できないので注意が必要です。
5.ビタミンD
検査フロー
| 試料採取 |
|
| | |
|
| 加熱けん化 |
水酸化カリウム |
| | |
|
| 溶媒抽出 |
ヘキサン-酢酸エチル混液 |
| | |
|
| 精 製 |
逆相高速液体クロマトグラフで分画 |
| | |
|
| 測 定 |
順相高速液体クロマトグラフで分析 |
食品中のビタミンD含有量は極微量であるため、精製には2段階の高速液体クロマトグラフが使われます。栄養表示基準の方法は逆相の高速液体クロマトグラフで分取し、順相の高速液体クロマトグラフで分析を行います。順相の高速液体クロマトグラフではVD2とVD3を分離できないため、結果は合わさったものになります。栄養表示基準の方法には掲載されていませんが、VD2とVD3を分別したいときは、順相の高速液体クロマトグラフで分取し、逆相の高速液体クロマトグラフで分析を行います。
加熱けん化中にビタミンDの一部がプレビタミンDになる熱異性化が起こるため、注意書きには、ビタミンD標準品を同時に加熱けん化し熱異性化されるビタミンDを相殺(プレ化率を同じにする)して定量するとされています。
6.ビタミンE
検査フロー
| 試料採取 |
|
| | |
|
| 加熱けん化 |
水酸化カリウム |
| | |
(試料が油脂の場合は省略可) |
| 溶媒抽出 |
ヘキサン-酢酸エチル混液 |
| | |
|
| 測 定 |
順相高速液体クロマトグラフで分析 |
試料をアルカリで加熱けん化を行うことにより不純物の除去行い、不けん化物をヘキサン-酢酸エチル混液で抽出し順相の高速液体クロマトグラフで測定します。ビタミンE含量が高く不純物の少ない油脂類の場合は、加熱けん化による精製を省略し直接ヘキサンで希釈し測定することも可能です。
ビタミンE同族体(α、β、γ、δ)の扱いが、平成18年7月よりα-トコフェロールのみをビタミンEとすることに改正されているので、それ以前に測定されたものはα-トコフェロール当量=α + 40/100β + 10/100γ + 1/100δとなっているので注意が必要です。
7.ビタミンK
検査フロー
| 試料採取 |
|
| | |
|
| 溶媒抽出 |
アセトンで磨砕抽出後ジエチルエーテルで液液分配 |
| | |
|
| 精 製 |
シリカゲルカラムで精製 |
| | |
分析上妨害が無い場合は省略可 |
| 測 定 |
逆相高速液体クロマトグラフ 白金黒カラムで還元 |
試料をアセトンで磨砕抽出し、ジエチルエーテルで分配したものをシリカゲルカラムで精製を行い、精製したものを逆相の高速クロマトグラフで測定します。還元型のビタミンKは蛍光で感度良く測定できますので、高速液体クロマトグラフでのカラム分離後、白金黒カラムを通すことで還元型ビタミンKにして蛍光検出します。
他の脂溶性ビタミンはジエチルエーテル抽出からヘキサン-酢酸エチル混液の抽出に変わってきていますが、ビタミンKの抽出だけが残されたままになっています。今後、変更される可能性があります。
栄養表示基準の方法はフィロキノンとメナキノン-4の測定になっていますが、納豆などはメナキノン-7が多く含まれています。今後、追加される可能性はありますが、標準品がないため、定量方法が明らかになっていません。
8.ビタミンのマイクロバイオアッセイ(微生物定量法)
ナイアシン、パントテン酸、ビオチン、ビタミンB6、ビタミンB12、葉酸の6種類のB群ビタミンは微生物定量法を使用するためまとめて解説します。
動物や微生物などの生物を利用して目的とする物質の量や効力を測定(評価)する方法をバイオアッセイと言います。よく知られているのはラットやマウスを用いた動物試験ですが、食品のビタミン分析分野では酵母や乳酸菌を用いたマイクロバイオアッセイが使われます。
ビタミンのマイクロバイオアッセイ法は微生物の増殖度合を測定し,目的のビタミン量を求める方法です。目的のビタミンを必須栄養素として要求する微生物は、ある濃度範囲内で目的のビタミン量に比例して増殖することを利用し、微生物の増殖度合を測定することによって、目的のビタミンの量を求めます。この方法は微生物の生物活性を利用するため目的のビタミンの活性があるものをすべて測定することになります。
? 具体的には、微生物の増殖に必要なすべての栄養素から目的のビタミンのみを除いた培地に試料抽出液を加えて培養し,同時に培養した目的のビタミン標準溶液との増殖度合の比較により定量を行います。増殖度合の測定には比濁法や酸度滴定法が用いられます。
ビタミンのマイクロバイオアッセイ法の特徴は、微生物の生育に左右される、微生物の生育(増殖)が悪いとばらつきが大きくなる、検量線範囲が狭い、増殖度合いが比例状態にあるところでしか測定できない、操作が煩雑であるなどのマイナス面がある一方、目的のビタミン活性のあるものを総量として測定できる、夾雑物の影響が少ない(前処理が簡便) 感度がよい(非常に少ない量を測ることが出来る)などのメリットの方が大きいため今日でも使用されている分析方法です。
バイオアッセイ部分の検査フロー
| 前培養 |
|
| | |
菌株 乳酸菌、酵母
|
| | |
培地 前培養培地 |
| | |
培養 乳酸菌35℃、酵母30℃ 20 時間 |
| 遠心分離 |
|
| | |
|
| 洗 浄 |
滅菌生理食塩水 |
| | |
|
| 接種菌液 |
滅菌生理食塩水にて適時調整 |
| | |
(透過率で80〜90%) |
| | |
|
| | |
|
| | |
|
| | |
|
| | |
|
└ |
|
| |
|
| |
| 培 養 |
乳酸菌(37℃? 18 時間)、酵母(30℃ 20 時間) |
|
| |
|
| |
|
培養時間や温度、接種菌液の透過率は目安と考え、状況に応じて柔軟に可変させた方が微生物の生育がコントロールしやすいので、常に生育の状況を見ておく必要があります。
ビタミンの微生物定量法に使用される菌株
ナイアシン,パントテン酸,ビオチン
Lactobacillus plantarum ATCC 8014
ビタミンB12
Lactobacillus delbrueckii subsp. lactis (L.leichmannii) ATCC 7830
葉酸
Lactobacillus rhamnosus(L.casei) ATCC 7469
ビタミンB6
Saccharomyces cerevisiae(S.uvarum)ATCC 9080
(1)ナイアシン(ナイアシン当量として)
栄養表示基準の方法には、『高速液体クロマトグラフ法』と『ナイアシン定量用基礎培地法』が収載されています。
食品中のナイアシンはニコチン酸とニコチン酸アミドとそれらの結合型であるヌクレオチド型からなります。食品中のナイアシンを測定する場合は、遊離体にする必要があります。高速液体クロマトグラフ法は水抽出ですので、添加された遊離体のニコチン酸とニコチン酸アミドのみの測定となります。さらに、別々に測定し後で合算する必要があります。一方、ナイアシン定量用基礎培地法はニコチン酸とニコチン酸アミドの両方に応答する菌株を使用するため、硫酸での加圧(オートクレーブ)抽出 により遊離型にしたニコチン酸とニコチン酸アミドを総量で定量します。分別定量の必要も無く感度よく測定できます。これらのことにより、栄養表示基準の方法ではナイアシン定量用基礎培地法が推奨されています。
ナイアシン定量用基礎培地法の場合、標準品にニコチン酸を使用しますので、厳密にはニコチン酸相当量となります。しかし、ニコチン酸とニコチン酸アミドの分子量はあまり変わらないため、ニコチン酸相当量をナイアシンとしても差し支えないとされています。
当量計算では平成15年の改正から新たにトリプトファンが考慮になっていますので、たんぱく質含量の高い食品では注意が必要です。
・ナイアシン当量(mg/100g)
=ニコチン酸【HPLC法】+ニコチン酸アミド 【HPLC法】 +1/60トリプトファン
・ナイアシン当量(mg/100g) =ナイアシン【微生物定量法】 +1/60トリプトファン
HPLC法:高速液体クロマトグラフ法
微生物定量法:ナイアシン定量用基礎培地法
(2)パントテン酸
栄養表示基準の方法には『微生物定量法』が収載されていますが、注意書きに『高速液体クロマトグラフ法』も紹介されています。
パントテン酸は食品中に広く分布しており、食品中では結合体と遊離体で存在していますが、微生物定量法で使用される菌株は遊離体のみに応答しますので、全てを遊離体にする必要があります。
微生物定量法は本文に載っている方法より、注意書きに載っている方法の方が取り扱いやすく実用的です。
抽出はパントテン酸が酸やアルカリに不安定であるため、加水分解は酵素によって行います。標準品はパントテン酸カルシウムですが、表示はパントテン酸であるので係数0.92を掛けて補正します。
(3)ビオチン
栄養表示基準の方法には『微生物定量法』が収載されていますが、注意書きで『高速液体クロマトグラフ法』にも触れられていますが詳細は載せられていません。
ビオチンはどの食品にも存在し、ほとんどのものはたんぱく質と結合していますが、微生物定量法に使用する菌株は結合体には応答しないので、抽出時に遊離体しておく必要があります。
抽出はビオチンが酸に対して安定であるので硫酸による加圧(オートクレーブ)抽出を行います。ビオチンは生卵白に含まれるアビジンと強固に結合するため注意が必要です。
(4)ビタミンB6
栄養表示基準の方法には『微生物定量法』が収載されていますが、注意書きに『高速液体クロマトグラフ法』も紹介されています。
食品中のビタミンB6はピリドキシン、ピリドキサール、ピリドキサミンの3種類の遊離型とその結合型が存在します。
高速液体クロマトグラフ法はそれぞれの化合物を測定しなければなりませんが、微生物定量法はピリドキシン、ピリドキサール、ピリドキサミンに応答する菌株を使用するため分別定量の必要はありません。しかし、結合体には応答しませんので、抽出時に遊離体にする必要があります。 ビタミンB6は酸に対して安定であるため、酸性状態下(塩酸又は硫酸)で加圧(オートクレーブ)抽出を行い遊離型にします。動物性食品には0.055mol/L塩酸を植物性食品には0.5mol/L硫酸を用いることが注意書きに載っています。
標準品にピリドキシン塩酸塩を使用しますが、表示はビタミンB6(ピリドキシン換算)であるので係数0.8227を掛けて補正します。
(5)ビタミンB12
栄養表示基準の方法には『微生物定量法』が収載されていますが、注意書きに『高速液体クロマトグラフ法』も紹介されています。
食品に含まれるビタミンB12はシアノコバラミンの他、アデノシルコバラミンやメチルコバラミンなどの数多くの類縁体があります。
微生物定量法に使用する菌株はビタミンB12の類縁体すべてには応答しないか活性が違うので、抽出時にシアノコバラミンに変換しておく必要がります。
抽出は弱酸性状態下でシアン化カリウムと加熱することにより類縁体をシアノコバラミンに変換させます。栄養表示基準の方法には記載されていませんが、使用する菌株はビタミンB12ではないヌクレオチドなどに活性があるため、熱アルカリ処理によってビタミンB12を分解したものをブランクとして差し引く必要があります。
(6)葉酸
栄養表示基準の方法には『微生物定量法』が収載されていますが、注意書きに『高速液体クロマトグラフ法』も紹介されています。
葉酸はプテロイルグルタミン酸のことですが、食品中には還元型やグルタミン酸が重合した形で存在しています。
微生物定量法に使用する菌株はプテロイルポリグルタミン酸には応答しないので、抽出時にプテロイルモノグルタミン酸に変換しておく必要があります。
葉酸は分解しやすいので、抽出には弱酸性還元状態下で抽出し、コンジュガーゼ処理によってポリグルタミン酸をモノグルタミン酸にします。 コンジュガーゼ処理に使用する酵素であるチキンパンクレアスは現在販売されていないので、注意書きにあるブタ腎臓コンジュガーゼを使用します。葉酸に使用する酵素には酵素自体に葉酸が含まれるので精製の必要があります。
参考図書
五訂増補 日本食品標準成分表分析マニュアル 建帛社
新食品分析ハンドブック 建帛社
栄養・食糧学 データハンドブック 同文書院
四訂 早わかり栄養表示基準 解説とQ&A 中央法規
|







